
Contatore di cellule
Al contatore di cellule: Cellule PC-12
Coltivate per la prima volta da Greene e Tischler nel 1976, le cellule PC-12 derivano da un feocromocitoma (tumore neuroendocrino) della midollare del surrene di ratto. Sono state sviluppate come linea cellulare modello e come alternativa alle colture di cellule cromaffini primarie della ghiandola surrenale. Le cellule PC-12 possono differenziarsi in cellule simili ai neuroni in presenza di fattore di crescita nervoso o desametasone. A causa della loro capacità di differenziamento e facilità di crescita in coltura, le cellule PC-12 vengono utilizzate in una varietà di aree di ricerca che vanno dagli studi di efficacia dei farmaci alla neurosecrezione.
Visualizza il webinar sulla rilevazione di cellule con la tecnologia StainFree
Scarica la nota applicativa sulla rilevazione di cellule con la tecnologia StainFree
Scarica l’eBook: Count Cells Like a Pro
Figura 1. Confronto tra conta cellulare con la tecnologia StainFree e conta cellulare in fluorescenza
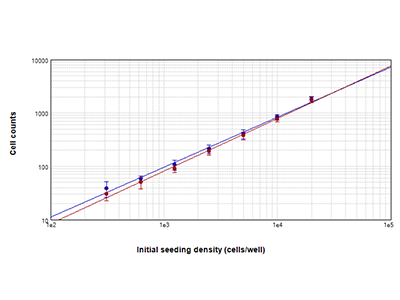
Cellule PC-12 contate utilizzando la tecnologia di rilevazione cellulare StainFree™ (cerchietti blu) e un colorante nucleare rosso (cerchietti rossi). Le conte ottenute con i due metodi presentano un elevato grado di concordanza, a dimostrazione che la tecnologia StainFree fornisce conte cellulari precise eliminando la necessità di utilizzare coloranti fluorescenti (r2 > 0,99 per ciascun tracciato).
Figura 2. Curve di crescita ottenute utilizzando l’analisi delle aree coperte con la tecnologia StainFree
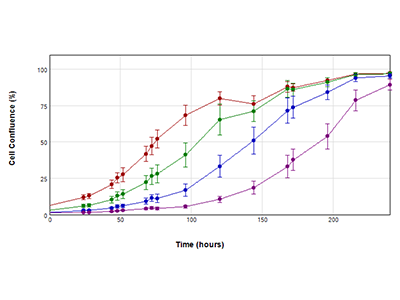
Curve di crescita delle cellule PC-12 in un periodo di dieci giorni. Le cellule sono state inizialmente seminate a una densità di 2000 (rosso), 1000 (verde), 500 (blu) e 200 (viola) cellule. La confluenza cellulare è stata misurata ogni 24 ore utilizzando la funzione di analisi del campo del software SoftMax Pro. Il calo di confluenza osservato a 144 ore (*) nella popolazione seminata a una densità iniziale di 2000 cellule è probabilmente dovuto a una deplezione dei nutrienti nel terreno di coltura; il terreno è stato inizialmente sostituito ogni tre giorni, ma a partire dalle 144 ore è stato sostituito quotidianamente.
Figura 3. Analisi StainFree delle cellule PC-12 con colorazione mitocondriale
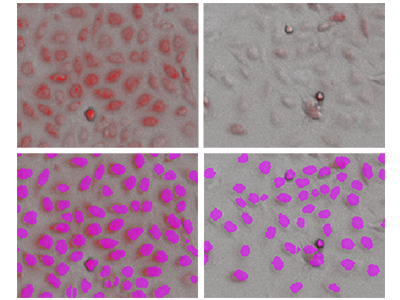
La fila superiore mostra le immagini ottenute in luce trasmessa sovrapposte a quelle ottenute con una colorazione (mitocondriale) fluorescente rossa. La fila inferiore mostra l’analisi StainFree con le singole cellule (maschere viola) identificate dal software. A sinistra, cellule non trattate; a destra, cellule trattate con valinomicina 1 µM. Per ogni singola cellula identificata è stato possibile calcolare l’intensità della colorazione mitocondriale.
Figura 4. Curve IC50 relative alle cellule PC-12 trattate con valinomicina
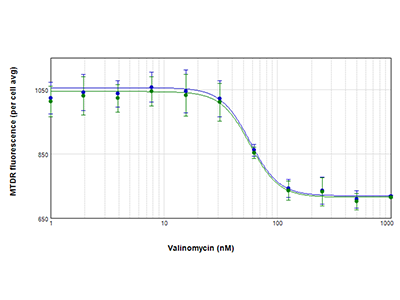
Le cellule PC-12 sono state trattate con valinomicina e analizzate per rilevare l’attività mitocondriale utilizzando il colorante MitoTracker™ Deep Red FM (MTDR). Sono mostrate le curve della risposta concentrazione-dipendente per le cellule analizzate utilizzando la tecnologia StainFree (blu) o una colorazione nucleare fluorescente (verde) per identificare le singole cellule. Nel grafico è riportata la fluorescenza mitocondriale media per cellula in funzione della concentrazione di valinomicina. Con i due metodi di analisi sono state ottenute curve quasi identiche e in entrambi i casi il valore IC50 è risultato pari a 57 nM.
Suggerimento 1:
Per contare le cellule PC-12 senza colorazione, è consigliabile creare una nuova impostazione utilizzando gli strumenti di disegno disponibili nel software. Scegliete l’analisi di oggetti distinti e poi utilizzate gli strumenti di disegno per definire le cellule e le aree non coperte da cellule nelle immagini minime e massime. Per ottenere conte più precise in presenza di agglomerati densi di cellule, provate a definire le cellule disegnando immediatamente all’interno dei loro bordi. Viceversa, se notate che il software conta più cellule di quelle presenti nelle immagini, provate a eseguire il tracciato delle cellule leggermente all’esterno dei bordi.
Suggerimento 2:
Con la funzione di analisi del campo del software SoftMax Pro è facile ottenere le curve di crescita. Questa funzione calcola la percentuale di area coperta da cellule (confluenza) presente nelle immagini. La misurazione della confluenza delle cellule può essere un utile strumento per un migliore sviluppo dei saggi. Ad esempio, potrebbe essere necessario seminare le cellule a due o più densità di prova, calcolarne la confluenza subito prima del saggio e, una volta ottenuti i risultati, determinare quale livello di confluenza ha fornito i valori migliori.
Kit di strumenti per l’analisi delle cellule PC-12
- Piattaforma di rilevazione per micropiastre multimodale SpectraMax® i3
- Citometro per imaging SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
Impostazione dello strumento
Informazione sulla tecnologia di rilevazione cellulare StainFree
Solitamente, i saggi di imaging basati su cellule richiedono l’uso di sonde fluorescenti che possono essere tossiche per le cellule vive o funzionare soltanto in cellule fissate. Un metodo senza marcatura per l’analisi delle conte cellulari e della confluenza cellulare permette ai ricercatori di monitorare in maniera quantitativa la proliferazione e la salute delle cellule senza dover ricorrere a flussi di lavoro laboriosi che potrebbero compromettere la vitalità cellulare.
La piattaforma per micropiastre multimodale SpectraMax i3 con citometro per imaging MiniMax 300 utilizza l’esclusiva tecnologia di rilevazione cellulare StainFree con brevetto depositato per permettervi di eseguire saggi di proliferazione cellulare, di citotossicità e di altro tipo senza coloranti nucleari come il DAPI, che si intercala nel DNA, o coloranti per cellule vive, che a lungo termine sono in realtà tossici per le cellule.