
Contatore di cellule
Al contatore di cellule: Cellule U937
Le cellule U937 sono state isolate da un linfoma istiocitico di un paziente di sesso maschile di 37 anni nel 1974. Poiché si tratta di una delle poche linee cellulari disponibili che esprimono numerose caratteristiche monocitiche, vengono spesso utilizzate per studiare il comportamento e il differenziamento dei monociti. Le cellule U937 vanno incontro ad apoptosi quando trattate con il fattore di stimolazione delle colonie di granulociti-macrofagi (Granulocyte-Macrophage Colony-Stimulating Factor, GM-CSF; Okuma et al., 2000), una caratteristica che li rende un modello utile per lo studio della segnalazione nelle cellule apoptotiche.
Visualizza il webinar sulla rilevazione di cellule con la tecnologia StainFree
Scarica la nota applicativa sulla rilevazione di cellule con la tecnologia StainFree
Scarica l’eBook: Count Cells Like a Pro
Figura 1: immagini ottenute utilizzando il citometro SpectraMax MiniMax

Le cellule U937 sono state identificate utilizzando l’impostazione di analisi predefinita “CellsC” del software SoftMax Pro. A sinistra, immagine in luce trasmessa; a destra, analisi StainFree con maschere viola che indicano le cellule identificate dal software.
Figura 2: conte cellulari con la tecnologia StainFree e con colorante fluorescente
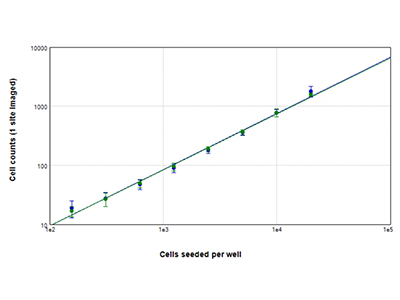
Cellule U937 sono state seminate a densità comprese tra 156 e 20.000 cellule per pozzetto e i nuclei sono stati colorati utilizzando il colorante EarlyTox™ Live Green Dye. Le immagini sono state acquisite da 1 sito per pozzetto. Il numero di cellule presenti in ciascuna immagine è stato poi determinato utilizzando il metodo StainFree (tracciato blu) o contando i nuclei fluorescenti verdi (tracciato verde).
Figura 3: Saggio EarlyTox Live/Dead
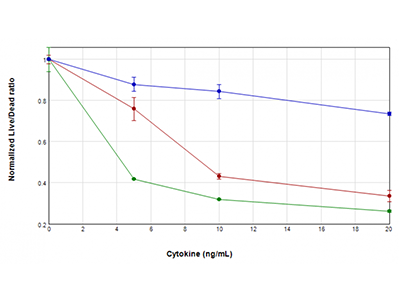
Le cellule U937 sono state trattate con concentrazioni di GM-CSF (tracciato blu), TNFα (tracciato rosso) o TNFα più GM-CSF (tracciato verde) comprese tra 0 ng/ml e 20 ng/ml per 48 ore. Sono state poi analizzate per determinare la vitalità utilizzando il kit del saggio EarlyTox™ Live/Dead. La fluorescenza è stata rilevata utilizzando il lettore per micropiastre multimodale SpectraMax i3x. Il rapporto del segnale fluorescente delle cellule vive/morte è stato riportato in grafico in funzione della concentrazione delle citochine, rivelando una riduzione della vitalità cellulare nelle cellule trattate, che è risultata particolarmente marcata quando il TNFα e il GM-CSF erano combinati.
Figura 4: Saggio EarlyTox Caspase-3/7 R110
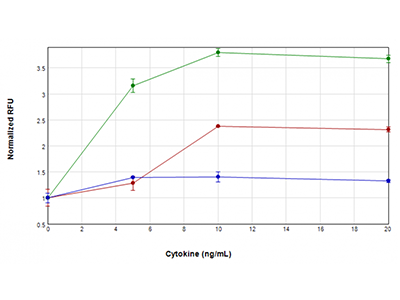
Le cellule U937 sono state trattate con concentrazioni di TNFα più GM-CSF (tracciato verde), solo TNFα (tracciato rosso) o solo GM-CSF (tracciato blu) comprese tra 0 ng/ml e 20 ng/ml per 48 ore. Sono state poi analizzate per determinare l’attività della caspasi-3/7 utilizzando il saggio EarlyTox™ Caspase-3/7 R110. Il segnale fluorescente indicativo dell’attività della caspasi è stato rilevato utilizzando il lettore SpectraMax i3x. La massima attività della caspasi è stata osservata quando le cellule sono state trattate con TNFα e GM-CSF, a suggerire un effetto sinergico sull’attivazione della caspasi.
Figura 5: saggio EarlyTox Caspase-3/7 NucView 488
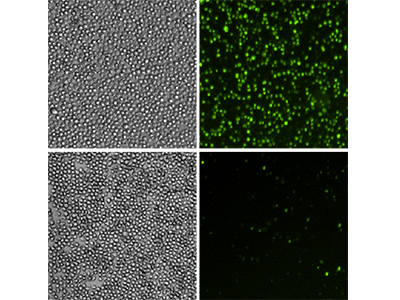
Le cellule U937 sono state trattate con 10 ng/ml di TNFα e GM-CSF (fila superiore) o lasciate non trattate (fila inferiore) per 48 ore. Sono state poi analizzate utilizzando il saggio EarlyTox™ Caspase-3/7 NucView™ 488. Le cellule con caspasi-3/7 attiva sono state identificate in base alla colorazione fluorescente verde. Pannelli a sinistra, immagini delle cellule in luce trasmessa; pannelli a destra, immagini in fluorescenza verde che rivelano le cellule con capsasi-3/7 attiva.
Suggerimento:
Le cellule U937 crescono in sospensione e hanno una forma arrotondata che le rende facili da contare. Per la conta con la tecnologia StainFree, è sufficiente utilizzare l’impostazione di analisi predefinita “CellsC” nel menu a discesa del software SoftMax Pro per analizzare le immagini delle cellule con un singolo clic.
Kit di strumenti per l’analisi delle cellule U937
- Piattaforma di rilevazione per micropiastre multimodale SpectraMax ® i3
- Citometro per imaging SpectraMax ® MiniMax™ 300
- Software SoftMax ® Pro
Luce trasmessa (TL)
541 nm (fluorescenza verde)
Esposizione in TL: 7 ms
Regolazione del fuoco in TL: -5 µm
Esposizione 541: 1 ms
Regolazione del fuoco 541: 40 µm
Tipo di analisi: Analisi di oggetti distinti
Lunghezza d’onda per l’identificazione di oggetti: TL (StainFree) o 541 (nuclei verdi)
TL: CellsC (predefinita)
541: Impostare dimensioni e intensità: Dimensioni = 10-30 µm, Intensità al di sopra del background = 150
Informazione sulla tecnologia di rilevazione cellulare StainFree
Solitamente, i saggi di imaging basati su cellule richiedono l’uso di sonde fluorescenti che possono essere tossiche per le cellule vive o funzionare soltanto in cellule fissate. Un metodo senza marcatura per l’analisi delle conte cellulari e della confluenza cellulare permette ai ricercatori di monitorare in maniera quantitativa la proliferazione e la salute delle cellule senza dover ricorrere a flussi di lavoro laboriosi che potrebbero compromettere la vitalità cellulare.
La piattaforma per micropiastre multimodale SpectraMax i3/i3x con citometro per imaging MiniMax 300 utilizza l’esclusiva tecnologia di rilevazione cellulare StainFree con brevetto depositato per permettervi di eseguire saggi di proliferazione cellulare, di citotossicità e di altro tipo senza coloranti nucleari come il DAPI, che si intercala nel DNA, o coloranti per cellule vive, che a lungo termine sono in realtà tossici per le cellule.