
Contatore di cellule
Al contatore di cellule: Cellule HeLa
Le cellule HeLa sono state la prima linea cellulare coltivata in laboratorio e a tutt’oggi vengono ancora utilizzate in innumerevoli progetti di ricerca biomedica. Derivano da cellule tumorali della cervice prelevate nel 1951 da Henrietta Lacks, una paziente successivamente deceduta a causa della malattia. Il bestseller di Rebecca Skloot “The Immortal Life of Henrietta Lacks” (La vita immortale di Henrietta Lacks) racconta l’affascinante storia della sua vita e del suo retaggio.
Visualizza il webinar sulla rilevazione di cellule con la tecnologia StainFree
Scarica la nota applicativa sulla rilevazione di cellule con la tecnologia StainFree
Scarica l’eBook: Count Cells Like a Pro
Figura 1. Confronto tra l’analisi StainFree e la conta cellulare in fluorescenza
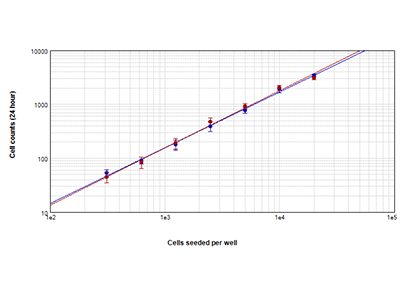
Cellule HeLa contate utilizzando la tecnologia di rilevazione cellulare StainFree™ (cerchietti blu) e un colorante nucleare rosso (cerchietti rossi). Le conte ottenute con i due metodi presentano un elevato grado di concordanza, a dimostrazione che la tecnologia StainFree fornisce conte cellulari precise eliminando la necessità di utilizzare coloranti fluorescenti (r > 0,99 per ciascun tracciato).
Figura 2. Curve di crescita ottenute utilizzando l’analisi delle aree coperte con la tecnologia StainFree
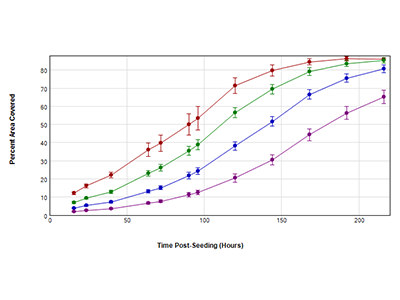
Le cellule HeLa sono state seminate a 4 diverse densità iniziali in una piastra a 96 pozzetti: 250 (viola), 500 (blu), 1000 (verde) e 2000 (rosso) cellule per pozzetto. Le immagini delle cellule sono state acquisite con il canale in luce trasmessa (Transmitted Light, TL) per 9 giorni. La percentuale di area coperta dalle cellule in ciascun punto temporale è stata determinata mediante l’analisi StainFree.
Figura 3. Misurazione della citotossicità mediante la tecnologia StainFree
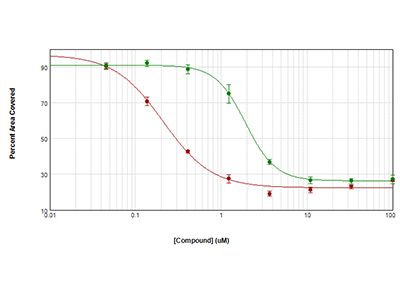
Le cellule HeLa sono state seminate a una densità di 1000 cellule per pozzetto e lasciate crescere per tutta la notte. Quindi sono state trattate con anisomicina (cerchietti rossi) o tricostatina (cerchietti verdi) per 72 ore. La citotossicità è stata misurata calcolando la percentuale di area coperta mediante l’analisi StainFree. Le curve IC50 sono state riportate in grafico con il software SoftMax Pro.
Figura 4. Immagini di cellule HeLa trattate con composti tossici

Fila superiore: Le cellule HeLa sono state trattate con concentrazioni basse (sinistra) o alte (destra) di anisomicina e le immagini sono state acquisite nel canale in luce trasmessa (Transmitted Light, TL). Fila inferiore: Le cellule HeLa sono state trattate con concentrazioni basse (sinistra) o alte (destra) di staurosporina ed è stata analizzata la citotossicità con il kit per l’integrità cellulare EarlyTox. Le cellule vive sono marcate in rosso e quelle morte sono marcate in rosso e in verde.
Suggerimento 1:
Per contare le cellule HeLa senza colorazione, è possibile utilizzare l’impostazione predefinita “CellsA” nel software SoftMax Pro oppure creare una nuova impostazione utilizzando gli strumenti di disegno disponibili nel software. Il metodo di analisi da utilizzare dipenderà dalla morfologia e dalle condizioni di crescita delle cellule. Provate innanzitutto a utilizzare l’impostazione predefinita e verificate se funziona in maniera efficace.
Suggerimento 2:
Con la funzione di analisi del campo disponibile nel software SoftMax Pro è facile ottenere curve di crescita come quelle mostrate qui. Questa funzione calcola la percentuale di area coperta da cellule (confluenza) presente nelle immagini. Il calcolo della confluenza cellulare può anche essere utile per lo sviluppo di saggi. Ad esempio, è possibile analizzare le cellule seminate a diverse densità iniziali e verificare quale fornisce risultati migliori nel saggio.
Suggerimento 3:
È facile monitorare la citotossicità nel tempo. È sufficiente analizzare la percentuale di area coperta da cellule nei punti temporali desiderati e riportare in grafico i risultati nel software SoftMax Pro. Non è necessario colorare o raccogliere le cellule.
Kit di strumenti per l’analisi delle cellule HeLa
- Piattaforma di rilevazione per micropiastre multimodale SpectraMax® i3
- Citometro per imaging SpectraMax® MiniMax™ 300
- Software SoftMax® Pro
- Kit per l’integrità cellulare EarlyTox™
Impostazione dello strumento
Tipo di analisi: Analisi di oggetti distinti
Lunghezza d’onda per l’identificazione di oggetti: TL
Informazione sulla tecnologia di rilevazione cellulare StainFree
Solitamente, i saggi di imaging basati su cellule richiedono l’uso di sonde fluorescenti che possono essere tossiche per le cellule vive o funzionare soltanto in cellule fissate. Un metodo senza marcatura per l’analisi delle conte cellulari e della confluenza cellulare permette ai ricercatori di monitorare in maniera quantitativa la proliferazione e la salute delle cellule senza dover ricorrere a flussi di lavoro laboriosi che potrebbero compromettere la vitalità cellulare.
La piattaforma per micropiastre multimodale SpectraMax i3 con citometro per imaging MiniMax 300 utilizza l’esclusiva tecnologia di rilevazione cellulare StainFree con brevetto depositato per permettervi di eseguire saggi di proliferazione cellulare, di citotossicità e di altro tipo senza coloranti nucleari come il DAPI, che si intercala nel DNA, o coloranti per cellule vive, che a lungo termine sono in realtà tossici per le cellule.