
Contatore di cellule
Al contatore di cellule: Cellule MCF-7
Poiché ottobre è il mese della prevenzione del tumore al seno, abbiamo deciso di parlare della linea cellulare di carcinoma mammario MCF-7. Derivata nel 1970 da una monaca che si chiamava Suor Catherine Frances (Helen Marion) Mallon, questa linea cellulare deve il suo nome alla Michigan Cancer Foundation, dove è stata generata. Le cellule MCF-7 sono una delle poche linee cellulari di carcinoma mammario che esprimono livelli considerevoli di recettore degli estrogeni (Estrogen Receptor, ER) alfa, per cui offre ai ricercatori un utile sistema modello per lo studio dei tumori della mammella ER-positivi. Facendo una ricerca per “MCF-7 cells” in PubMed, si ottengono oltre 20.000 riferimenti bibliografici relativi a questa importante linea cellulare.
Visualizza il webinar sulla rilevazione di cellule con la tecnologia StainFree
Scarica la nota applicativa sulla rilevazione di cellule con la tecnologia StainFree
Scarica l’eBook: Count Cells Like a Pro
Figura 1: immagini ottenute utilizzando il citometro SpectraMax MiniMax
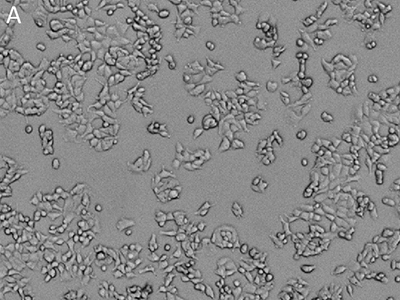
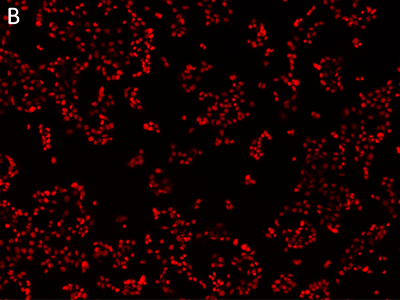

Le cellule MCF-7 sono state colorate con il colorante EarlyTox™ Live Red Dye e poi sottoposte a imaging utilizzando il citometro SpectraMax MiniMax. Le cellule sono state identificate con un’impostazione personalizzata definita dall’utente. A, immagine in luce trasmessa; B, nuclei colorati con il colorante EarlyTox Live Red Dye; C, cellule identificate mediante analisi StainFree (le maschere viola mostrano le cellule identificate dal software).
Figura 2: conte cellulari con la tecnologia StainFree e con colorante fluorescente
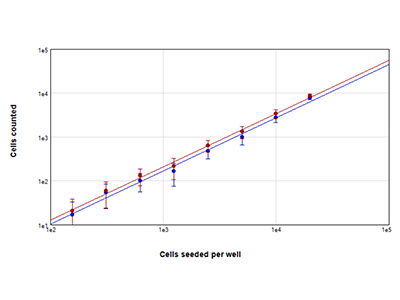
Cellule MCF-7 sono state seminate a densità comprese tra 156 e 20.000 cellule per pozzetto e i nuclei sono stati colorati utilizzando il colorante EarlyTox Live Red Dye. Sono state acquisite immagini relative a 4 siti per pozzetto ed è stata selezionata per l’analisi una regione di interesse al centro dei pozzetti. Il numero di cellule presenti è stato poi determinato utilizzando il metodo StainFree (tracciato blu) o contando i nuclei fluorescenti rossi (tracciato rosso).
Figura 3: Saggio EarlyTox Live/Dead
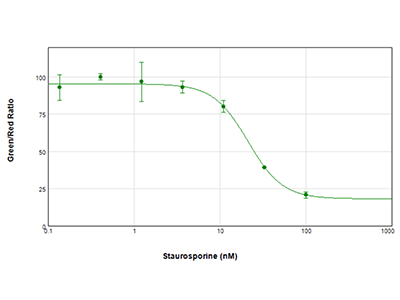
Le cellule MCF-7 sono state trattate con diluizioni seriali di staurosporina per 24 ore e poi analizzate con il kit del saggio EarlyTox Live/Dead di Molecular Devices. Le cellule vive sono state colorate con calceina AM (colorante verde) e quelle morte con un omodimero di etidio (colorante rosso). La piastra è stata letta sul lettore per micropiastre multimodale SpectraMax i3x. I risultati sono stati riportati in grafico come rapporto verde/rosso in funzione della concentrazione del composto ed è stato calcolato un valore IC50 pari a 21,2 nM utilizzando il software SoftMax Pro.
Suggerimento:
Le cellule MCF-7 presentano una morfologia poligonale con dimensioni irregolari e tendono a raggrupparsi in grandi aggregati. Per la conta cellulare con la tecnologia StainFree, selezionate “Create New Setting” (Crea nuova impostazione) e tracciate i contorni delle cellule leggermente all’interno dei loro bordi utilizzando lo strumento di disegno giallo. Utilizzate lo strumento di disegno blu per contrassegnare le aree all’esterno dei bordi delle cellule. In alternativa, è possibile utilizzare l’impostazione predefinita “CellsC”, ma potrebbe non essere altrettanto accurata.
Kit di strumenti per l’analisi delle cellule MCF-7
- Piattaforma di rilevazione per micropiastre multimodale SpectraMax ® i3x
- Citometro per imaging SpectraMax ® MiniMax™ 300
- Software SoftMax ® Pro
Luce trasmessa (TL)
713 nm (fluorescenza rossa)
Esposizione in TL: 7 ms
Regolazione del fuoco in TL: -10 µm
Esposizione 713: 6 ms
Regolazione del fuoco 713: 0 µm
Tipo di analisi: Analisi di oggetti distinti
Lunghezza d’onda per l’identificazione di oggetti: TL (StainFree) o 713 (nuclei rossi)
Informazione sulla tecnologia di rilevazione cellulare StainFree
Solitamente, i saggi di imaging basati su cellule richiedono l’uso di sonde fluorescenti che possono essere tossiche per le cellule vive o funzionare soltanto in cellule fissate. Un metodo senza marcatura per l’analisi delle conte cellulari e della confluenza cellulare permette ai ricercatori di monitorare in maniera quantitativa la proliferazione e la salute delle cellule senza dover ricorrere a flussi di lavoro laboriosi che potrebbero compromettere la vitalità cellulare.
La piattaforma per micropiastre multimodale SpectraMax i3 con citometro per imaging MiniMax 300 utilizza l’esclusiva tecnologia di rilevazione cellulare StainFree con brevetto depositato per permettervi di eseguire saggi di proliferazione cellulare, di citotossicità e di altro tipo senza coloranti nucleari come il DAPI, che si intercala nel DNA, o coloranti per cellule vive, che a lungo termine sono in realtà tossici per le cellule.