
Contatore di cellule
Al contatore di cellule: Cellule RBL
Lo sviluppo di linee cellulari di leucemia basofila di ratto (Rat Basophilic Leukemia, RBL) negli anni ‘70 del secolo scorso ha offerto ai ricercatori un sistema modello pratico, anche se imperfetto, per lo studio dei mastociti, che sono cellule difficile da ottenere. Per studiare le vie biochimiche coinvolte nella secrezione nei mastociti sono state utilizzate le cellule RBL-2H3, ottenute mediante subclonaggio di una delle linee cellulari RBL originali. Alcune linee cellulari RBL vengono coltivate come cellule in sospensione, mentre altre sono aderenti. Poiché la morfologia delle cellule può variare in condizioni di crescita diverse, o anche all’interno della stessa coltura, la possibilità di creare un’impostazione di analisi StainFree personalizzata è estremamente utile per ottenere conte cellulari precise.
Visualizza il webinar sulla rilevazione di cellule con la tecnologia StainFree
Scarica la nota applicativa sulla rilevazione di cellule con la tecnologia StainFree
Scarica l’eBook: Count Cells Like a Pro
Figura 1: Conte cellulari con la tecnologia StainFree
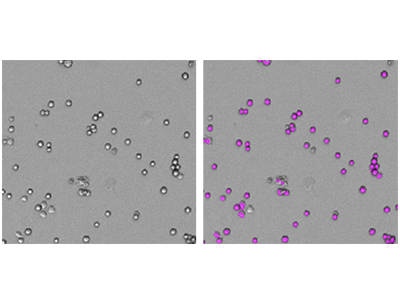
Immagini di cellule RBL-1 acquisite con il citometro per imaging SpectraMax i3 MiniMax 300. Le cellule sono state identificate utilizzando un’impostazione di analisi personalizzata definita dall’utente. A sinistra è mostrata l’immagine originale in luce trasmessa e a destra è visibile la stessa immagine con maschere viola che indicano le cellule identificate dal software.
Figura 2: Conte cellulari con la tecnologia StainFree e con colorante nucleare fluorescente
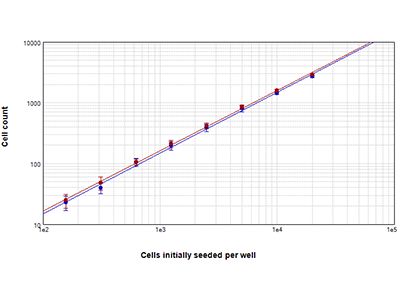
Cellule RBL-1 seminate a densità comprese tra 156 e 20.000 cellule per pozzetto sono state contate utilizzando la tecnologia StainFree (punti blu) oppure sono state colorate con il colorante EarlyTox™ Live Red Dye, dopodiché sono stati contati i nuclei fluorescenti rossi (punti rossi). Le conte cellulari ottenute con i due metodi hanno presentato un elevato tasso di concordanza lungo l’intero intervallo di densità delle cellule. Le conte cellulari sono state misurate all’interno di una regione di interesse (Region of Interest, ROI) definita dall’utente.
Figura 3: Saggio FLIPR Calcium 6 sul lettore per micropiastre multimodale FlexStation 3
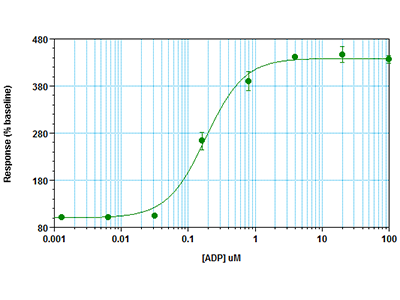
Cellule RBL-2H3 sono state seminate a una densità di 30.000 cellule per pozzetto in una piastra a 96 pozzetti e incubate per tutta la notte. Il giorno successivo, il terreno di coltura è stato rimosso e sono stati aggiunti nei pozzetti il colorante del saggio FLIPR® Calcium 6 e probenecid, dopodiché le cellule sono state incubate per 2 ore. È stato quindi eseguito un saggio cinetico in fluorescenza su un lettore per micropiastre multimodale FlexStation® 3. Il pipettatore integrato ha somministrato l’agonista ADP nei pozzetti del saggio e il lettore per piastre ha simultaneamente misurato sul fondo dei pozzetti il segnale fluorescente indicante la mobilizzazione del calcio.
Figura 4. Saggio Fura-2 QBT per il calcio sul lettore per micropiastre multimodale3 FlexStation
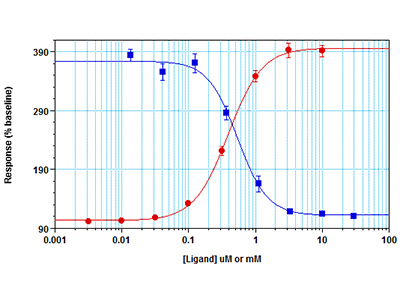
Cellule RBL-2H3 sono state seminate a una densità di 30.000 cellule per pozzetto in una piastra a 96 pozzetti e incubate per tutta la notte. Il giorno successivo, sono state incubate con il colorante Fura-2 QBT™ per 60 minuti dopo la rimozione del terreno di coltura. Per gli studi sull’IC50, è stato aggiunto alle cellule l’inibitore YM-58483 per 45 minuti prima di eseguire il saggio. È stato quindi eseguito un saggio cinetico in fluorescenza su un lettore per micropiastre multimodale FlexStation 3. Il pipettatore integrato ha somministrato nei pozzetti CaCl2 alla concentrazione EC80 (per il saggio con l’inibitore, punti blu) o in una serie di titolazione (punti rossi). Il lettore per piastre ha simultaneamente misurato sul fondo dei pozzetti il segnale fluorescente indicante la mobilizzazione del calcio.
Suggerimento:
Poiché nelle colture in sospensione di cellule RBL sono spesso presenti alcune cellule aderenti, nel software SoftMax Pro può essere molto utile un’impostazione di analisi creata dall’utente per “addestrare” il software a identificare soltanto le cellule con la morfologia tipica di quelle che crescono in sospensione e a escludere le cellule attaccate. Per le colture di cellule aderenti, la cui morfologia può variare, un’impostazione di analisi creata dall’utente permette di ottimizzare l’identificazione di tutte le cellule, indipendentemente dalla loro forma.
Kit di strumenti per l’analisi delle cellule RBL
- Piattaforma di rilevazione per micropiastre multimodale SpectraMax ® i3
- Citometro per imaging SpectraMax ® MiniMax™ 300
- Software SoftMax ® Pro
Impostazioni dello strumento per l’imaging e la conta cellulare
Esposizione: 7 ms
Regolazione del fuoco: 20 µm
Tipo di analisi: Analisi di oggetti distinti
Lunghezza d’onda per l’identificazione di oggetti: TL
Informazione sulla tecnologia di rilevazione cellulare StainFree
Solitamente, i saggi di imaging basati su cellule richiedono l’uso di sonde fluorescenti che possono essere tossiche per le cellule vive o funzionare soltanto in cellule fissate. Un metodo senza marcatura per l’analisi delle conte cellulari e della confluenza cellulare permette ai ricercatori di monitorare in maniera quantitativa la proliferazione e la salute delle cellule senza dover ricorrere a flussi di lavoro laboriosi che potrebbero compromettere la vitalità cellulare.
La piattaforma per micropiastre multimodale SpectraMax i3 con citometro per imaging MiniMax 300 utilizza l’esclusiva tecnologia di rilevazione cellulare StainFree con brevetto depositato per permettervi di eseguire saggi di proliferazione cellulare, di citotossicità e di altro tipo senza coloranti nucleari come il DAPI, che si intercala nel DNA, o coloranti per cellule vive, che a lungo termine sono in realtà tossici per le cellule.