7 suggerimenti per ottimizzare il flusso di lavoro per l’imaging e l’analisi cellulare 3D
Mentre il campo della biologia cellulare si muove verso una maggiore complessità dei test, i sistemi di cellule 3D hanno dimostrato di fornire informazioni più rilevanti dal punto di vista fisiologico rispetto ai tradizionali test 2D per la ricerca di nuovi farmaci e la modellizzazione delle malattie. Nei sistemi 2D tradizionali, le cellule si estendono, aderiscono e crescono su una superficie piana, mentre i sistemi 3D imitano meglio l’ambiente tissutale in vivo attraverso interazioni cellula-cellula/ECM, penetrazione del composto e risposta alla dose.
Con una maggiore complessità dei test 3D, si presentano nuove difficoltà relative all'imaging cellulare, come tempi di acquisizione e analisi delle immagini più lunghi, nonché requisiti di archiviazione dei dati più elevati. Utilizzando gli strumenti e le tecniche corretti, è possibile superare queste difficoltà e ottenere dati affidabili in modo più efficiente.
Ecco sette suggerimenti per ottimizzare il flusso di lavoro di diagnostica per immagini e analisi delle celle 3D.
1. Utilizzare la strumentazione e la tecnologia adeguate per l'imaging di colture di cellule 3D
Quando si lavora con le coltivazioni di cellule 3D, non è sufficiente acquisire un'immagine di un piano cellulare, come nelle tradizionali coltivazioni di cellule 2D. Invece è necessario acquisire una serie di immagini in piani verticali (tipicamente 10-15 immagini), indicate come z-stack. Le piattaforme di acquisizione di immagini confocali automatiche, come il sistema di acquisizione di immagini ad alto contenuto microconfocale ImageXpress® , consentono di acquisire immagini di una sezione ottica più sottile della struttura 3D e di ridurre significativamente l’oscuramento dello sfondo, con conseguente migliore risoluzione delle immagini e dettagli cellulare più fini. Anche gli obiettivi di immersione in acqua del sistema ImageXpress giocano un ruolo chiave nel migliorare la qualità dell’immagine.
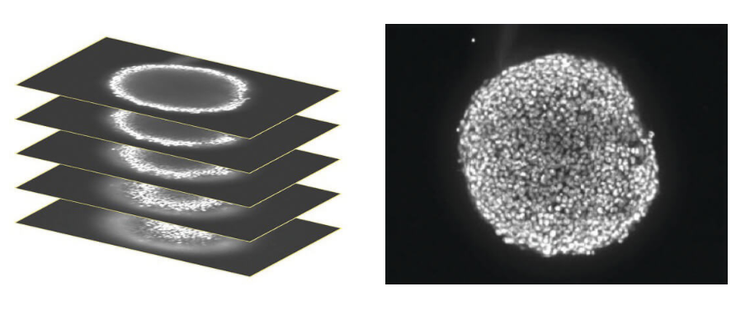
Una pila di immagini confocali è stata acquisita nel piano z che copriva circa la metà della profondità dello sferoide (sinistra). Solo alcune celle dello sferoide sono a fuoco su un determinato piano, quindi per facilitare l'analisi, le immagini sono state ridotte in una singola immagine 2D per combinare le aree di messa a fuoco (destra).
2. Utilizzare micropiastre progettate specificamente per l’imaging 3D
È importante utilizzare micropiastre progettate specificamente per l’imaging 3D . Di solito si tratta di 96- o 384- piastre inferiori ben chiare. Le piastre a U rotonde di Corning sono pratiche per la realizzazione di sferoidi e sono anche l'ideale per l'imaging 3D. Queste piastre consentono di mantenere lo sferoide centrato e in posizione durante l'acquisizione dell'immagine. Le piastre inferiori piatte dall'altra parte tendono a essere problematiche, in quanto rendono difficile mantenere il campione centrato.
3. Seguire le tecniche corrette di preparazione delle cellule prima dell’imaging
È importante considerare il tipo di campione 3D che si sta utilizzando, poiché campioni diversi hanno requisiti diversi di preparazione e diagnostica per immagini. Quando si tratta di oggetti solidi, come sferoidi o campioni di tessuto spessi, c'è una distanza limitata che si può visualizzare a causa della limitata penetrazione della luce e della luce che causa interferenza delle cellule. In alternativa, le cellule in matrici come Matrigel sono trasparenti, consentendo di visualizzare l'oggetto ed eseguire l'analisi con una maggiore penetrazione della luce.
La colorazione di oggetti cellulari 3D come gli sferoidi può essere complicata, poiché i coloranti devono penetrare non solo nella superficie, ma anche nella parte interna del campione. Nel caso del mezzo di contrasto Hoechst, utilizzato per la colorazione nucleare, potrebbe essere necessario utilizzare una concentrazione 2X-3X maggiore per ottenere una penetrazione efficace. A sua volta, potrebbe essere necessario consentire una durata più lunga per la colorazione. In genere un colore come Hoechst richiede 15-20 minuti per la colorazione. Tuttavia, quando si tratta di sferoidi, potrebbe essere necessario attendere 2-3 ore per la colorazione. Alcuni coloranti sono lipofilici e possono rimanere bloccati sulla superficie invece di penetrare nel campione. La colorazione con gli anticorpi è particolarmente impegnativa e gli esperti stanno ancora lavorando per sviluppare dei protocolli di colorazione efficaci.
4. Individuare la posizione centrale del campione 3D all'inizio dell'acquisizione dell'immagine
Per avviare il processo di diagnostica per immagini, è necessario prima trovare la posizione dell'oggetto al centro del sito di diagnostica per immagini e trovare la prima messa a fuoco che si trova approssimativamente al centro della posizione z (posizione verticale). Ad esempio, se si sta eseguendo l'imaging di uno sferoide che ha un diametro di circa 500 micron, la posizione iniziale sarebbe di circa 50 micron al di sopra del fondo del pozzetto. In questa posizione iniziale, è quindi possibile regolare l'esposizione e gli offset per canali diversi.
A volte gli sferoidi si staccano dal centro, quindi potrebbe essere necessario regolare le dimensioni della piastra per assicurarsi che gli sferoidi siano centrati. È anche possibile controllare attraverso la placca in angoli diversi per assicurarsi che gli sferoidi siano visibili.
5. Definire la gamma dell'acquisizione di immagini 3D, dall'inizio alla fine
Ciò comporta l’acquisizione di una pila di immagini a diverse profondità all’interno dell’oggetto e la definizione precisa di dove è necessario iniziare, dove è necessario terminare e anche la definizione del numero di passi intermedi. In genere per un obiettivo 10X, si può iniziare con una distanza di 8-10 μm tra i passi. Per un obiettivo 20X, si inizia con una distanza di 3-5 μm tra i passi e così via.
Sebbene l'aumento del numero di passi migliori la qualità dell'analisi e della visualizzazione, un numero eccessivo di immagini può prolungare il tempo di acquisizione e analisi e l'archiviazione dei dati di sovraccarico. Inoltre, l'acquisizione di troppe immagini potrebbe causare lo sbiadimento del campione. In ultima analisi, si tratta di provare a trovare il giusto equilibrio. In genere utilizzo due diversi protocolli per una singola piastra. Uno usa una distanza maggiore tra le slice e l’altro usa meno.
È inoltre molto importante specificare il tipo di immagine di proiezione che si desidera acquisire all'inizio dell'acquisizione. In genere per l'immagine confocale, l'oggetto è impostato su "immagine di proiezione massima", che genera automaticamente molte informazioni relative al campione. A questo punto, è possibile scegliere di analizzare solo l'immagine di proiezione al posto dell'analisi 3D per accelerare il processo.
6. Utilizzare gli obiettivi QuickID e immersione in acqua per ridurre il tempo di acquisizione delle immagini
Durante l'acquisizione, gli oggetti 3D possono allontanarsi dal centro del pozzetto, rendendoli difficili da trovare. Questo è particolarmente vero se si sta trattando di sferoidi in piastre a fondo piatto. Per superare questa difficoltà, il nostro sistema ImageXpress Micro Confocal include una funzione chiamata Acquisizione di immagini target QuickID . Le immagini del sistema a basso ingrandimento per trovare l'oggetto di interesse, quindi acquisisce automaticamente l'oggetto di interesse in un singolo campo visivo a un ingrandimento maggiore. Questo riduce significativamente i tempi di acquisizione e i requisiti di archiviazione dei dati. Anche l'uso di obiettivi di immersione in acqua è vantaggioso, in quanto raccolgono un segnale più elevato dal campione 3D, consentendo di ridurre il tempo di esposizione e aumentare la velocità di acquisizione.
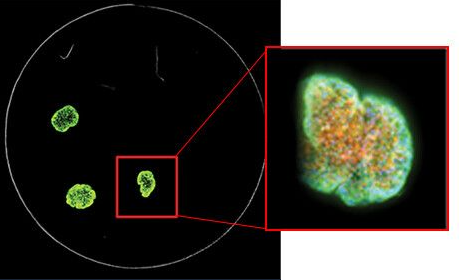

7. Utilizzare il software di analisi 3D appropriato
I nostri sistemi di imaging cellulare includono il software di acquisizione e analisi delle immagini ad alto contenuto MetaXpress®, che fornisce molti strumenti per rendere l’analisi un processo più semplice. L'approccio più semplice sarebbe quello di combinare le aree di messa a fuoco per la pila di immagini in una singola proiezione 2D utilizzando l'algoritmo di massima proiezione del software. È possibile utilizzare gli strumenti per la normale analisi 2D, come i nuclei di conteggio, la valutazione delle cellule e la crescita dei neuriti .
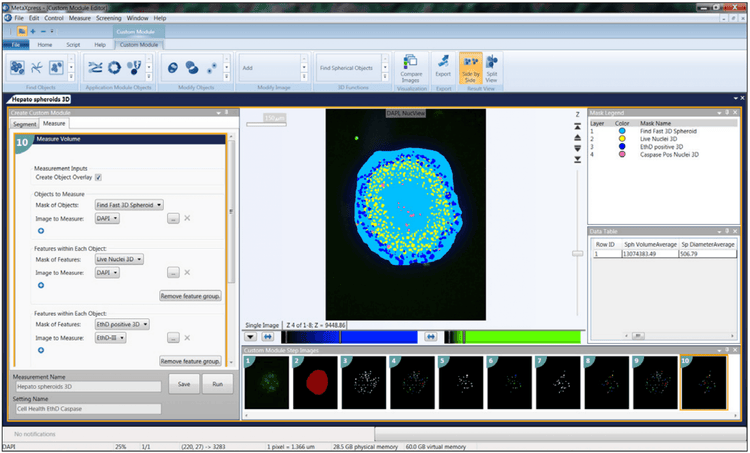
Per l'analisi 3D, è possibile trovare oggetti di interesse in ogni z-stack e quindi abbinarli. Ad esempio, se si lavora con sferoidi o celle in Matrigel, lo strumento “Trova oggetto rotondo” consente di trovare l’oggetto in un unico passaggio una volta definite le dimensioni approssimative dell’oggetto e la soglia di intensità. Un altro strumento comune è “Connect by best match”. Qui, si seleziona il protocollo di analisi (ad es., conteggio dei nuclei, live/dead o valutazione delle cellule) ed eseguerlo separatamente per ogni sezione z. L'algoritmo collega quindi determinati oggetti tra sezioni z adiacenti in un volume 3D in base allo spostamento massimo degli oggetti tra le sezioni che si definiscono accettabili. È quindi possibile visualizzare gli oggetti in un formato 3D e, cosa più importante, è possibile eseguire un'analisi volumetrica 3D per identificare il volume, la distanza tra gli oggetti, ecc.
Per per saperne di più sull’ottimizzazione del flusso di lavoro di diagnostica per immagini e analisi delle celle 3D, consultare la nostra pagina web Modelli di celle 3D.