
Gli esperti di organoidi discutono: Esplorare le complessità e i vantaggi dell’imaging 3D nella ricerca sugli organoidi
La biologia umana è complessa e i macchinari complicati alla base di molti processi biologici e malattie non sono stati completamente scoperti. Poiché i modelli 2D non riassumono questa complessità, possono solo aiutarci a graffiare la superficie. La mancanza di strumenti robusti per prevedere l’efficacia e la sicurezza dei farmaci è uno dei motivi per cui oltre il 90% degli attuali farmaci candidati non supera le sperimentazioni cliniche (1). L’imaging 3D, fornendo modelli più pertinenti e accurati, offre il potenziale per migliorare questo aspetto; tuttavia, l’imaging 3D porta con sé anche le proprie sfide uniche che devono essere superate per un successo ottimale.
In un nuovo podcast con Drug Target Review, il Dott. Hilary Sherman (Senior Applications Scientist presso Corning Life Sciences) e la Dott.ssa Oksana Sirenko (Senior Manager of Assay Development presso Molecular Devices) discutono di come le tecnologie di imaging 3D possano colmare le lacune nella visualizzazione e nell’analisi di modelli cellulari complessi.
Hilary e Oksana hanno entrambe una notevole esperienza nello sviluppo e nell’utilizzo di modelli cellulari 3D. Discutono dei vantaggi che gli organoidi hanno nell’emulare e prevedere la biologia umana e le sue risposte, nonché delle sfide che possono presentarsi con l’imaging e l’analisi di questi campioni.
Perché il 3D rispetto al 2D?
I tessuti, gli organi e i tumori umani non sono strutture 2D piatte, ma complessi assemblaggi 3D composti da molti tipi di cellule differenti. Inoltre, processi biologici vitali, come l’assorbimento di nutrienti e farmaci, i gradienti di pH, la trasduzione del segnale, lo smaltimento dei rifiuti e le interazioni cellula-cellula, si verificano tutti in un contesto 3D. Questi fenomeni possono avere un impatto significativo sulla biologia cellulare e sui meccanismi d’azione dei farmaci, ma i modelli cellulari 2D convenzionali appena, se del caso, catturano questa complessità. Pertanto, i farmaci e i trattamenti che possono funzionare bene in un contesto 2D non producono la stessa efficacia se utilizzati in vivo. Questo scollegamento tra gli ambienti 2D e 3D spiega parzialmente perché molti farmaci che sembrano promettenti in laboratorio falliscono nelle sperimentazioni cliniche. Costruendo sistemi 3D, possiamo creare modelli cellulari biologicamente più rilevanti che imitano meglio gli effetti di un farmaco o di un trattamento nel “mondo reale”.
Vantaggi degli organoidi rispetto ad altri modelli cellulari 3D
Gli organoidi offrono anche vantaggi rispetto ad altri modelli di cellule 3D comunemente utilizzati.
Quando si tratta di rappresentare tessuti e organi umani complessi, gli organoidi e l’organo su chip adottano approcci diversi, sebbene l’obiettivo finale sia simile. Organ-on-a-chip richiede un’ampia conoscenza dell’organo e del suo ambiente oggetto di studio per un design funzionale e controllato. Al contrario, gli organoidi possono essere progettati più facilmente grazie alla capacità delle cellule staminali di auto-organizzarsi intrinsecamente e differenziarsi in tipi di cellule funzionali.
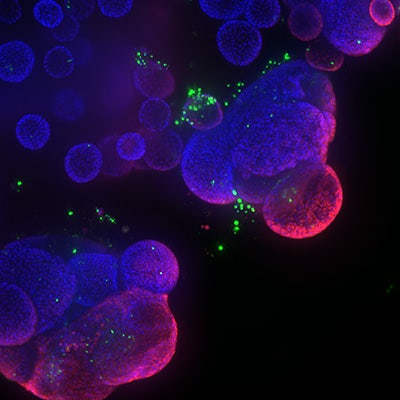
Organoidi polmonari
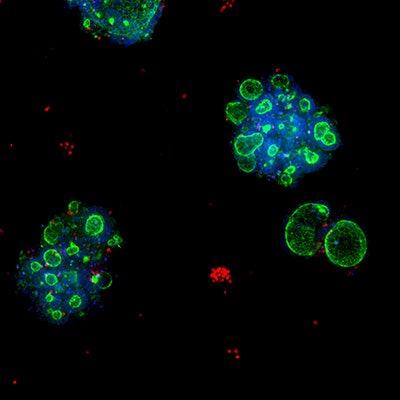
Organoidi colorettali
Gli organoidi possono essere utilizzati nella medicina personalizzata?
Le caratteristiche degli organoidi sopra descritti li rendono candidati ideali per la medicina personalizzata, specialmente per le malattie con varianti multiple in cui non esiste un farmaco che funzioni per tutti i pazienti. Molti sottotipi di tumore, come il carcinoma mammario triplo negativo, rientrano in questa categoria, con la risposta chemioterapica che varia notevolmente da paziente a paziente. Generando organoidi dalle biopsie dei pazienti, gli scienziati possono creare organoidi derivati dal paziente (Patient-Derived Organoids, PDO), noti anche come tumoroidi. Ciò consente loro di valutare l’effetto di vari composti su quel tipo di tumore specifico, consentendo loro di prevedere meglio la risposta dell’individuo al trattamento.
Complessità degli organoidi
Secondo Hilary, nonostante i flussi di lavoro standardizzati per lo sviluppo degli organoidi, è necessario prendere in considerazione molti fattori quando si lavora con gli organoidi. “Lavorare con gli sferoidi è semplice poiché è possibile utilizzare piastre analogamente alle colture cellulari 2D in crescita. Quando si inizia a lavorare con gli organoidi, il flusso di lavoro diventa molto più complesso a causa delle varie formulazioni dei terreni e della necessità di reagenti costosi, come i fattori di crescita”.
Un altro requisito è quello di utilizzare la matrice Corning® Matrigel® come matrice extracellulare (ECM), responsabile della determinazione dell’integrità o della polarità dell’organoide. Tuttavia, è un materiale difficile con cui lavorare a causa delle sue fluttuanti proprietà fisico-chimiche a temperature diverse, che non solo pone problemi per la manipolazione dei liquidi, ma richiede anche un’ulteriore ottimizzazione quando si esegue l’imaging della struttura 3D.
Ogni tipo di organoide presenta complessità aggiuntive uniche a causa della variabilità dei flussi di lavoro. Sebbene molti flussi di lavoro inizino differenziando le cellule pluripotenti indotte (iPCS) in cellule precursori, le fasi successive possono differire a seconda del tipo di cellula precursore (ad es., cardiaca, neuronale, epatica o intestinale). Per esempio, gli organoidi cerebrali (cervello) richiedono il trasferimento delle iPCS a un mezzo di induzione neuronale prima di trasferirle alle goccioline della matrice Matrigel. Un altro esempio è il flusso di lavoro degli organoidi intestinali/rettali in cui gli organoidi rettali vengono coltivati in micropozzetti a forma di fondo a U con micropattern Gri3D ® nell’idrogel per una maggiore complessità.

Immagini confocali ad alto ingrandimento di organoidi rettali umani esposti a citochine pro-infiammatorie. Immagini a singolo piano 4oX di F-actina (magenta) e DAPI (blu). Immagini 40X a piano singolo di F-actina (magenta) e DAPI (blu).
Sfide nell’imaging e nell’analisi delle immagini
Oltre alle complessità della biologia cellulare 3D, l’imaging di questi modelli può comportare anche difficoltà. Può essere più difficile per i reagenti di colorazione penetrare nella struttura e la mancanza di una sufficiente infiltrazione luminosa e di una messa a fuoco adeguata può influire sull’accuratezza dell’imaging
Quando si lavora con complessi organoidi 3D, gli scienziati devono tenere conto della penetrazione dei reagenti nel modello cellulare. Ecco perché possono essere necessarie considerazioni aggiuntive, come aumentare la concentrazione del tampone di permeabilizzazione, prolungare il tempo di incubazione o aumentare la concentrazione anticorpale.
Oksana sottolinea l’importanza di tempi di colorazione e fissaggio più lunghi: “Sebbene mezz’ora sia sufficiente per una coltura 2D, dobbiamo incubare gli organoidi per almeno due ore con la colorazione. Il fissaggio deve essere eseguito anche per almeno due ore, idealmente durante la notte”.
La modalità di imaging è un altro fattore cruciale, e sia la luce fuori fuoco che la penetrazione della luce possono rappresentare una sfida quando si esegue l’imaging degli organoidi. Tuttavia, funzionalità aggiuntive possono effettivamente migliorare la qualità dell'immagine. Ad esempio, la tecnologia a immersione in acqua aiuta ad aumentare sia la risoluzione che la sensibilità a diversi livelli di ingrandimento posizionando uno strato di acqua tra l'obiettivo e il campione, producendo immagini più nitide.
Gli organoidi sono spessi, quindi la sorgente luminosa deve avere una potenza di illuminazione sufficiente per migliorare la risoluzione dell'immagine e ridurre al minimo l'aberrazione. Tuttavia, con la luce LED standard, il raggiungimento della luminosità desiderata richiede lunghi tempi di acquisizione che possono determinare una riduzione dell'intensità dell'immagine e un possibile fotosbiancamento. Gli imager confocali avanzati, come il sistema di imaging ad alto contenuto ImageXpress® Confocal HT.ai, utilizzano una sorgente laser multicanale ad alta intensità per aumentare la sensibilità del saggio e ridurre al minimo i tempi di esposizione.
Infine, una messa a fuoco affidabile è un aspetto cruciale quando si esegue l’imaging degli organoidi per catturare diversi livelli di dettaglio senza sacrificare la risoluzione. Inoltre, combinando l’imaging confocale ad alto contenuto con un solido software di analisi delle immagini, i ricercatori possono generare profili fenotipici completi che includono dimensioni, area, volume, densità, distanza intercellulare e strutture subcellulari.
Un’altra sfida significativa durante la fase di analisi delle immagini è la complessità e l’eterogeneità degli oggetti e dei fenotipi degli organoidi, che presentano difficoltà per l’analisi. I metodi di analisi consentono la caratterizzazione di oggetti utilizzando più letture, tra cui volumi, aree, intensità, consentono anche di contare e caratterizzare le cellule e persino le strutture subcellulari all’interno degli organoidi. Strumenti di analisi avanzati che includono elementi di apprendimento automatico anche per ricavare informazioni sui fenotipi degli organoidi e sulle variazioni nei fenotipi a seguito di vari trattamenti.
Il futuro dello sviluppo e dell’imaging degli organoidi
Con la velocità con cui i protocolli degli organoidi stanno sviluppando e le tecnologie di imaging stanno progredendo, il passo successivo importante nella ricerca sugli organoidi è l’integrazione dell’automazione nei laboratori per migliorare la velocità del flusso di lavoro e aumentare la riproducibilità. Secondo Oksana, le soluzioni di automazione dei flussi di lavoro end-to-end sono agli albori.
“In precedenza ci siamo concentrati sull’automazione dell’imaging e dell’analisi delle immagini, ma il passo successivo è la capacità di automatizzare l’intero flusso di lavoro. Ciò comporta l’automazione di ogni parte dell’intero percorso cellulare: manipolatore di liquidi, incubatore, centrifuga, lettore di piastre: tutti collegati insieme da un sistema robotico in grado di navigare senza problemi tra ciascun componente. Il braccio robotico può spostare le piastre dall’incubatore al sistema di manipolazione dei liquidi per l’aggiunta di terreni, la piastratura cellulare e la colorazione. Può quindi trasferire le piastre al sistema di imaging e al software di analisi per l'analisi ad alto contenuto".
Un esempio di tale sistema automatizzato è l’Organoid Innovation Center costruito da Molecular Devices, una soluzione end-to-end che standardizza il processo di sviluppo degli organoidi con coltura cellulare, trattamento e incubazione, fino all’imaging, all’analisi e all’elaborazione dei dati.
Oltre all’automazione, l’ottimizzazione iniziale è un altro fattore che determina il successo dello studio sugli organoidi. Stati iliari: “Più tempo dedica a ottimizzare il processo di ricerca sugli organoidi in anticipo comprendendo la biologia e la struttura dello specifico tipo di organoide, più solida sarà la raccolta e l’analisi dei dati e migliore sarà la qualità dei dati relativi alle immagini”.
Quando si tratta di scoperta di farmaci e modellazione di malattie, la ricerca sugli organoidi è in rapida crescita e ha molte promesse. Quando si esplorano le opzioni per il proprio laboratorio, è importante investire indagini e risorse adeguate per sviluppare un flusso di lavoro semplificato che produca risultati riproducibili, affidabili e accurati. Se eseguiti in modo ottimale, i ricercatori possono trarre vantaggio da una maggiore produttività, una maggiore efficienza, una velocità di immissione sul mercato e, soprattutto, un miglioramento della qualità della vita dei pazienti.
Contatta oggi stesso uno dei nostri esperti per scoprire come possiamo aiutarti a semplificare il tuo flusso di lavoro di biologia 3D o organoidi.
- Mullard, Asher. "Parsare i tassi di successo clinico." La natura recensisce la ricerca di nuovi farmaci 15,7 ( 2016): 447-448.