Panoramica di TRF/TR-FRET (HTRF)
Fluorescenza a tempo risolto (TRF)
Le misurazioni dell’intensità della fluorescenza (IF) utilizzano fluorofori standard come la fluoresceina, la cui emissione è di breve durata, dell’ordine dei nanosecondi. L’eccitazione del campione e la misurazione dell’emissione avvengono simultaneamente. Sebbene i lettori per micropiastre siano molto efficaci nell’escludere la luce di eccitazione dalla misurazione dell’emissione, tale luce di eccitazione, insieme alla luce di breve durata emessa dai materiali nel pozzetto o nel campione, spesso contribuisce a creare un background elevato.
La fluorescenza a tempo risolto (Time-Resolved Fluorescence, TRF) riduce il background utilizzando un fluoroforo lantanide, come l’europio o il terbio, che emette una fluorescenza di lunga durata. Questa fluorescenza di lunga durata ha una durata di millisecondi, quindi l’eccitazione del fluoroforo da parte di una sorgente di luce pulsata (ad esempio una lampada a flash), seguita da un ritardo e poi dalla misurazione del segnale (“finestra di conteggio”), permette l’attenuazione della fluorescenza di breve durata (che dura solo per nanosecondi) prima che venga effettuata una misurazione. I saggi che utilizzano la fluorescenza a tempo risolto presentano rapporti segnale/rumore notevolmente più alti. I lantanidi utilizzati più frequentemente sono l’europio, il terbio e il samario. Questi elementi sono comunemente usati come complessi chelati o criptati che offrono una buona intensità e stabilità del segnale.
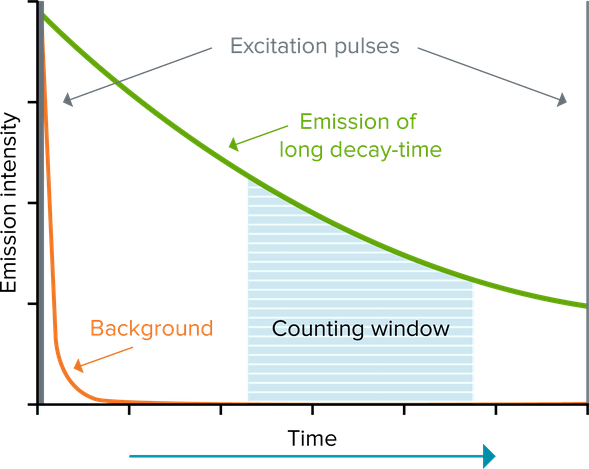
Trasferimento di energia per risonanza della fluorescenza a tempo risolto (TR-FRET)

nessun FRET FRET
Donatore e accettore sono distanti Donatore e accettore sono vicini
La TR-FRET combina la misurazione della fluorescenza a tempo risolto (TR) con la tecnologia di trasferimento di energia per risonanza della fluorescenza (Fluorescence Resonance Energy Transfer, FRET). Nei saggi FRET, le biomolecole (ad es. proteine) sono marcate con fluorofori donatori e accettori. Quando le biomolecole interagiscono, i fluorofori donatori e accettori si avvicinano. A questo punto, quando il donatore è eccitato, può trasferire la sua energia di emissione all’accettore, che a sua volta emette fluorescenza a una lunghezza d’onda specifica. Le emissioni di fluorescenza dell’accettore e del donatore hanno lunghezze d’onda diverse che possono essere distinte l’una dall’altra mediante un lettore per micropiastre, che permette di quantificare l’interazione biomolecolare.
Utilizzando fluorofori lantanidi, che presentano un’emissione di fluorescenza di lunga durata, come donatori, i saggi TR-FRET sfruttano la misurazione a tempo risolto della fluorescenza per eliminare la fluorescenza di fondo di breve durata. In un saggio TR-FRET, grazie all’emissione di lunga durata del fluoroforo donatore, l’eccitazione e l’emissione dei fluorofori donatore e accettore possono essere misurate anche dopo che la fluorescenza di fondo di breve durata si è attenuata.
Fluorescenza a tempo risolto omogenea (HTRF)
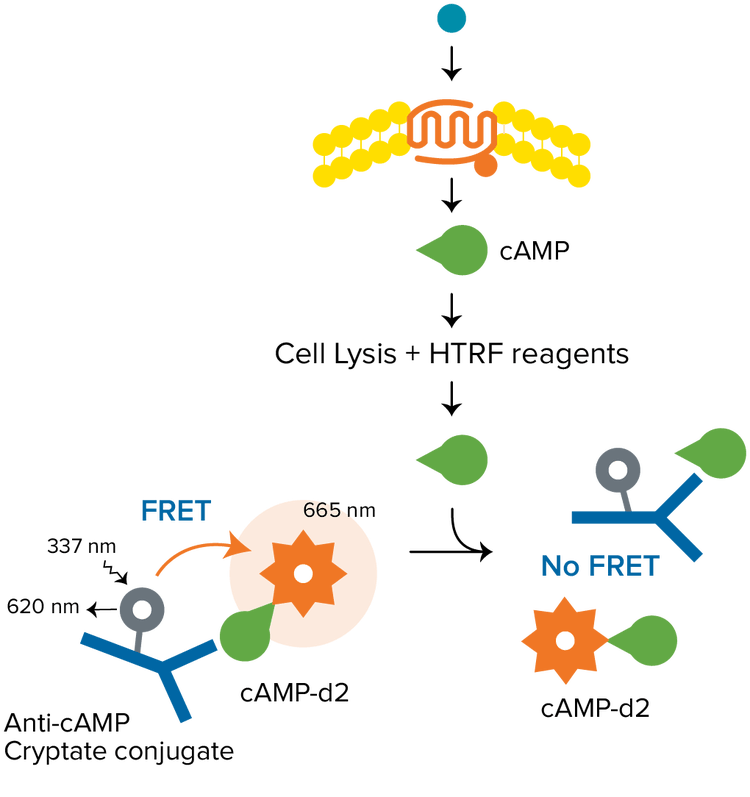
L’HTRF è una versatile tecnologia TR-FRET sviluppata da Cisbio per la rilevazione delle interazioni biomolecolari. In un tipico saggio HTRF viene utilizzato criptato di europio come donatore e il fluoroforo organico d2 come accettore. Il donatore e l’accettore possono essere utilizzati per marcare una varietà di biomolecole per applicazioni che includono epigenetica, quantificazione di biomarcatori, vie di segnalazione di GPCR e molto altro. I saggi HTRF richiedono un lettore per micropiastre con modalità di rilevazione della TRF cha sia certificato come compatibile con l’HTRF da parte di Cisbio.
Vantaggi e considerazioni
I principali vantaggi della TRF e del TR-FRET includono la riduzione del background e l’aumento del rapporto segnale/rumore rispetto alla fluorescenza standard, che permettono di ottenere una maggiore sensibilità. Inoltre, il saggio presenta un solido formato “mix-and-read” che non richiede alcun lavaggio. Questa caratteristica, insieme alla stabilità del saggio, facilita l’automazione e la miniaturizzazione per applicazioni di screening.
Applicazioni e saggi
I saggi TRF e TR-FRET (HTRF) permettono l’analisi delle interazioni molecolari nei processi biochimici e sono ampiamente utilizzati per saggi chinasici e per studiare vie di segnalazione cellulare, interazioni proteina-proteina, interazioni DNA-proteine, citotossicità cellulare e legami recettore-ligando.
Nella tabella a destra sono riportati esempi di saggi basati su TR-FRET e in basso sono indicate varie risorse per la fluorescenza a tempo risolto.