
Produzione accelerata di anticorpi monoclonali per il trattamento del SARS-CoV-2
Con le soluzioni di Molecular Devices, gli scienziati possono accelerare il processo di autorizzazione della FDA e accelerare la ricerca di anticorpi monoclonali
La sequenza temporale per identificare e sviluppare degli anticorpi neutralizzanti clinicamente efficaci contro le particelle virali dal banco al paziente è in genere 18 da a 24 mesi. La corsa mondiale per identificare gli anticorpi neutralizzanti efficaci contro la proteina spike del virus SARS-CoV-2 è divenuta una questione di vita e morte, poiché il pedaggio di morte globale è salito nel primo anno della pandemia di COVID-19.
Utilizzando una combinazione di strumenti CloneSelect da dispositivi Molecolari, con la stampante a cella singola CloneSelectý e l’immaginetore CloneSelect , la cronologia per lo sviluppo pre-clinico di anticorpi neutralizzanti efficaci può essere significativamente abbreviata. In effetti, la velocità con cui il mondo dei prodotti farmaceutici è stato in grado di creare e distribuire gli anticorpi monoclonali anti-SARS-CoV-2 parla della potenza e della promessa dell’automazione dello sviluppo delle linee cellulari.
In questo articolo, dimostriamo i passaggi per sviluppare gli anticorpi monoclonali con gli strumenti dei Dispositivi Molecolari, dalla selezione clonale al tracciamento della crescita cellulare, fino alla garanzia di linearità basata su immagini . Viene quindi generato un rapporto di linearità basato su immagini che deve essere incluso nelle applicazioni di licenza globali, come la domanda di licenza per prodotti biologici (BLA) all’ente statunitense per la tutela di alimenti e medicinali (FDA).
Anticorpi Monoclonali in alternativa alla terapia al plasma convalescente
Più di recente, sono disponibili per l’uso gli anticorpi monoclonali, gli anticorpi prodotti in laboratorio e clonati dai globuli bianchi, per trattare il virus SARS-CoV-2 . Il termine “cloninale” descrive una linea cellulare che ha origine da un singolo progenitore (cellula singola) e che documenta l’indicazione della clonalità richiesta per l’archiviazione regolamentare. I risultati preliminari hanno dimostrato che questi anticorpi forniscono supporto immunologico per almeno 5-7 mesi [ 5]. Considerato il potenziale terapeutico, la produzione rapida ed efficiente di anticorpi monoclonali è divenuta sempre più fondamentale.
C'è un problema con gli anticorpi monoclonali: il tempo dalla scoperta alle prove di prova di concetto. La cronologia dall'identificazione dell'anticorpo fino alla sperimentazione di fase I IND può richiedere fino a 10-12 mesi [ 6]. Tuttavia, con una trasfezione, una selezione e uno screening dei cloni rapidi ed efficienti, esistono modi per accelerare il processo e dimezzare la tempistica di produzione.
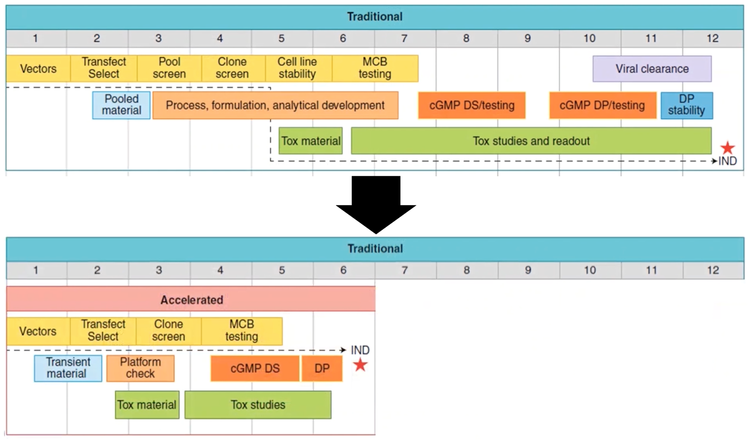
Figura 2 - Il tempo dalla scoperta alle prove di prova di concetto potrebbe essere ridotto a 5–6 mesi da una cronologia tradizionale di 10–12 mesi.
Flusso di lavoro per lo sviluppo accelerato degli antisostanze monoclonali
Poiché le normative per lo sviluppo di linee cellulari diventano sempre più rigorose, i ricercatori saranno tenuti a eseguire il cloning a singola cellula e a fornire la prova che una linea cellulare è derivata da una singola cellula, la prova della clonalità . I metodi dicloning tradizionali (ad es., limitazione della diluizione e FACS) utilizzano l'analisi statistica per determinare un livello di fiducia per la linearità. Tuttavia, la documentazione della monoclonalità ha determinato la necessità di tecnologie e metodologie più solide nel campo dei bioprocessi. Molti ricercatori ora utilizzano regolarmente sistemi di diagnostica per immagini, come l’Immaginer CloneSelect , per verificare la linearità e monitorare la crescita cellulare nei supporti di coltura cellulare.
Un flusso di lavoro di produzione ideale che genera una garanzia di linearità accettabile consiste nei seguenti passaggi.
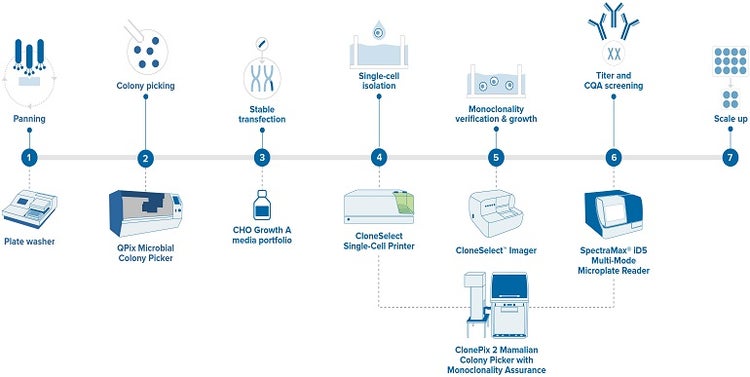
Figura 3 - Flusso di lavoro per lo sviluppo di un anticorpo monoclonale
Sfida 1: Isolamento di singole cellule
La chiave per una solida produzione di anticorpi monoclonali è isolare le singole cellule ad alte prestazioni. Tuttavia, ci sono varie difficoltà di isolamento a singola cellula, come ottenere un numero sufficiente di cellule target e mantenere la vitalità cellulare.
Limiting Diluizione (LD) è un metodo di isolamento tradizionale, in cui la coltura cellulare progenitrice viene sottoposta a una serie di diluizioni fino a quando non vi è una cellula per una piastra in un pozzetto in base ai calcoli di probabilità. Il principale inconveniente deriva dalla sua bassa efficienza di isolamento, il che significa che il numero di cellule per piastra fluttua tra zero e più cellule [ 7].
La citometria a flusso (FC) è un metodo di isolamento più efficace che mette in atto la smistamento delle cellule attivate dalla fluorescenza, ma che compromette la vitalità cellulare, a causa dell’alta pressione, dell’esposizione alla carica elettrica e delle frequenti collisioni ad alta velocità. Le condizioni non vitali portano a ciò che è noto come stress cellulare indotto dal sorter (SICS) [ 8]. Quindi, se si sta lavorando con tipi di cellule sensibili, la linea cellulare ottenuta dalla citometria a flusso potrebbe non essere adatta per ulteriori ricerche e impostare la cronologia di mesi.
La microfluidica , il processo di isolare le singole cellule nei chip microfluidici, sta diventando un'alternativa più efficiente ai metodi tradizionali. Un fattore che fa risaltare la microfluidica è la massiccia riduzione dei volumi di ingresso, mentre si caricano i campioni in chip microlitri. Poiché i microchip hanno una pressione di smistamento inferiore, il rischio di SICS viene anche ridotto. Infine, la microfluidica elimina il rischio di contaminazione da campione a campione [ 9].
Di recente abbiamo confrontato l'efficienza a cella singola di questi tre metodi. Per la dimostrazione dell’isolamento basato su microfluidicità, abbiamo utilizzato la nostra stampante a celle singole CloneSelect che unisce la tecnologia con l’imaging ad alta risoluzione per isolare le singole celle, registrando al contempo le prove di linearità basate sulle immagini. Come si può vedere nel grafico a barre sottostante, la stampante a cella singola CloneSelect ha superato LD e FC di 8 volte e 10- 20%, rispettivamente .
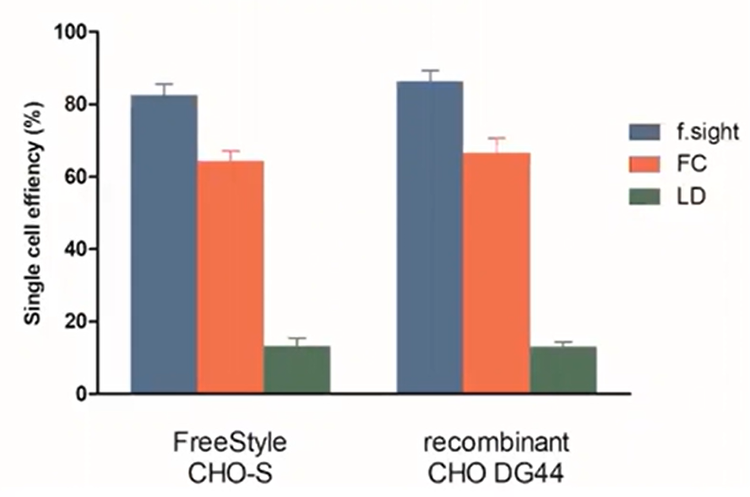
Figura 4 - Efficienza a cella singola: la f-sight ha un'efficienza di piastratura superiore a LD e FC.
Sfida 2: Efficienza di crescita coloniale
La prossima domanda è: Come si traduce l’efficienza a cella singola quando si sta cercando di generare colonie monoclonali?
Per il confronto della crescita esterna coloniale di microfluidica rispetto a LD e FC, abbiamo utilizzato l’Immaginer CloneSelect , che ci ha consentito di eseguire la scansione della divisione da una singola cella per 90 secondi. L’Immaginer CloneSelect ha fornito sia le statistiche del grafico che le anteprime visuali della crescita cellulare come prova. Poiché il CSI consente la successiva scansione della piastra per 14 giorni, è possibile risalire facilmente dall'immagine finale al giorno zero per dimostrare che la colonia effettivamente formata da una singola cella . Inoltre, è possibile esportare le immagini della colonia come rapporto PDF o Word per la garanzia di linearità basata sulle immagini.
Quindi, in che modo questo contribuisce a ridurre la cronologia? Invece dell'isolamento a due round per fornire una garanzia basata sulla probabilità e sull'immagine, si potrebbe utilizzare una stampante a cella singola e un imager in modo sinergico per un round di cloning. Questo metodo ha dimostrato di conferire una garanzia di linearità con oltre il 99,99% di fiducia [ 10].
I risultati sull'efficienza di crescita sono rappresentati di seguito per le cellule CHO sia a stile libero che ricombinanti .
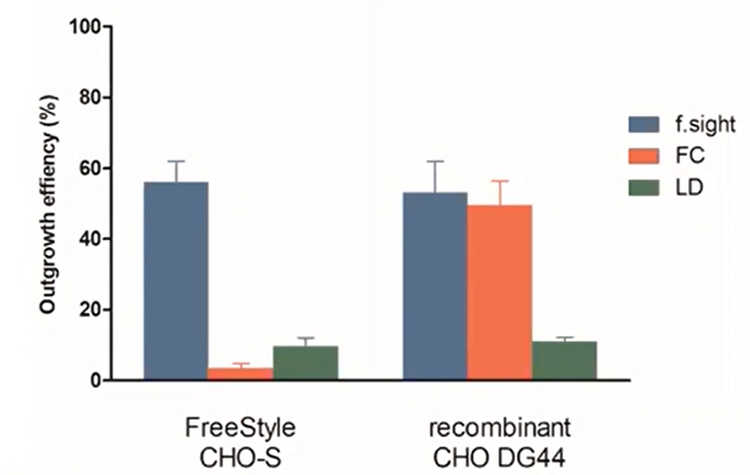
Figura 5 - Efficienza di crescita del colon: f.la vista mostra un miglioramento di oltre cinque volte della crescita clonale rispetto alla tradizionale diluizione limitante.
Simile all’efficienza a cella singola, la LD ha registrato prestazioni scadenti per entrambe le linee cellulari. È interessante notare che l’FC ha mostrato un’efficienza quasi uguale a quella della stampante a cella singola CloneSelect nelle cellule ricombinanti, ma 15 volte peggiore nelle celle di tipo libero. Ciò indica chiaramente che la stampante a cella singola CloneSelect, accoppiata con la tecnologia dell’ Imager CloneSelect, è più coerente in termini di crescita del colon rispetto all’FC.
Sfida 3: Grande monoclonalità su larga scala e certezze
L’isolamento dei cloni di cellule di mammifero possono essere faticosi e dispendiosi in termini di tempo, in quanto è necessario sottoporre a vaglio migliaia di migliaia di cloni non solo per la linearità ma anche per una sufficiente secrezione di anticorpi.
La divisione Dispositivi Molecolari ha messo a punto il sistema ClonePix® per un flusso di lavoro di sviluppo di linee cellulari automatiche end-to-end con prova di uniformità. Il sistema ClonePix è equipaggiato per sottoporre a vaglio e quantificare gli anticorpi neutralizzanti emessi da un gran numero di cloni CHO in situ . Il software utilizza una sonda di rilevamento fluorescente per quantificare la secrezione e preleva automaticamente i cloni con la resa più elevata.
Come illustrato di seguito, il ClonePix® supera LD in diversi aspetti. Non solo è in grado di sottoporre a vaglio un numero significativamente maggiore di colonie utilizzando un numero inferiore di piastre, ma anche di raccogliere le colonie che hanno rese più elevate.
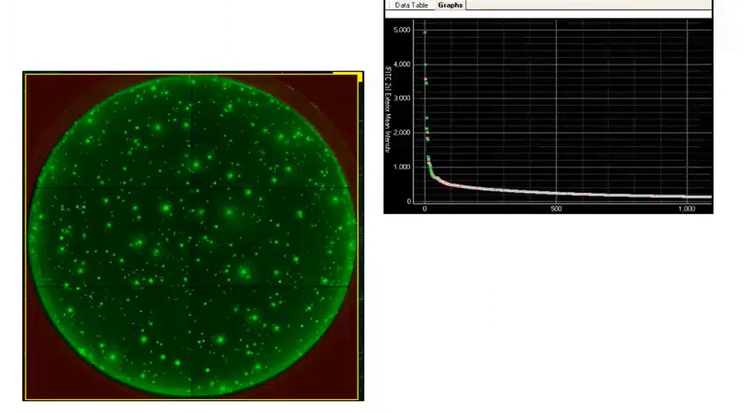
Figura 6 - ClonePix: in situ consente la data cumulativa piuttosto che un singolo punto temporale per determinare la produttività.
E per quanto riguarda la riduzione delle tempistiche? La versione originale del flusso di lavoro del dispositivo di prelievo delle colonne di mammifero ClonePix2 richiede due cicli di screening, come suggerito dalla FDA, in combinazione con la stampante a celle singole e l’immaginetore CloneSelect.
Esplora i flussi di lavoro pronti per l'automazione di laboratorio
Facciamo sì che le tue idee siano una realtà! Il nostro team di personalizzazione e automazione ha personalizzato con successo il dispositivo di prelievo delle colonne 2 di mammifero ClonePix per i clienti su richiesta, inclusi software e hardware. Ad esempio, aggiornando il sistema con ulteriori capacità di garanzia dell’anaclono, un singolo strumento può soddisfare tutte le esigenze del flusso di lavoro di produzione di un anticorporo, dallo screening dell’anticorpo al titolo, con un solo ciclo di screening del clono.
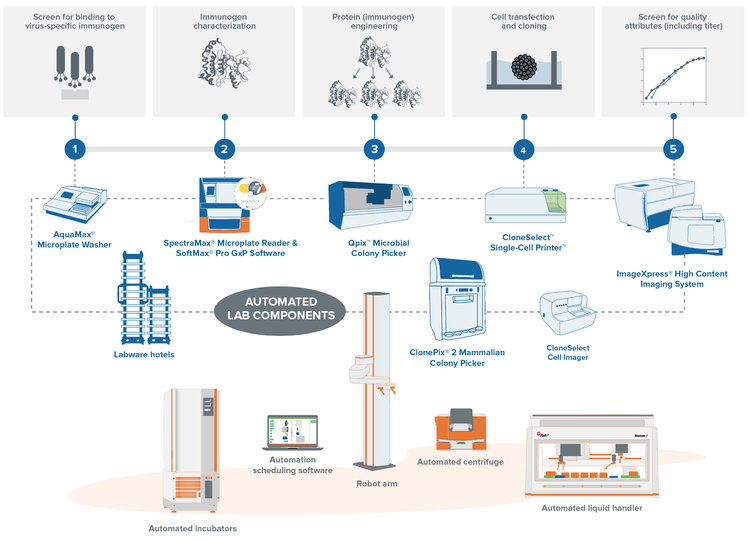
Con i flussi di lavoro di selezione dei cloni automatici di Molecular Devices, è possibile ridurre significativamente il carico sul laboratorio riducendo il tempo di preparazione manuale, creando al contempo un archivio centrale per i dati estratti da più processi. Le nostre soluzioni automatizzate combinano tutti i vostri dispositivi di laboratorio per aumentare il rendimento e l’efficienza riducendo la necessità di intervento umano.
Riferimenti bibliografici
- Mair-Jenkins, John, et al. “L’efficacia del plasma convalescente e dell’incolumità dell’incolumità per il trattamento delle gravi infezioni respiratorie gravi dell’eziologia virale: una revisione sistematica e una meta-analisi esplorativa." Il giornale delle malattie invasive 211,1 ( 2015): 80-90.Mair-Jenkins, John, et al. “L’efficacia del plasma convalescente e dell’immunoglobulina iperimmune per il trattamento di gravi infezioni respiratorie acute di eziologia virale: una revisione sistematica e una meta-analisi esplorativa”. Il Journal of infectious diseases 211,1 (2015): 80-90.
- Ko, Jae-Hoon, et al. "Sfide della terapia convalescente per l'infusione di plasma nell'infezione da coronavirus del tratto respiratorio medio-orientale: un’esperienza a centro singolo”. Antivir ther 23,7 ( 2018): 617-622.Ko, Jae-Hoon, et al. “Sfide della terapia di infusione plasmatica convalescente nell’infezione respiratoria da coronavirus in Medio Oriente: un’esperienza monocentrica”. Antivir ther 23,7 (2018): 617-622.
- Shen, Chenguang, et al. “Trattamento di pazienti in condizioni 5 critiche con COVID-19 con plasma convalescente”. Jama 323,16 ( 2020): 1582-1589.Shen, Chenguang, et al. “Trattamento di pazienti 5 gravemente malati con COVID-19 con plasma convalescente”. Jama 323,16 (2020): 1582-1589.
- Gontu, Abhinay, et al. “Finestra limitata per la donazione di plasma convalescente con alti titoli anticorpali neutralizzanti il virus vivo per l’immunoterapia anti-COVID-19”. Biologia delle comunicazioni 4,1 ( 2021): 1-9.Gontu, Abhinay, et al. “Finestra limitata per la donazione di plasma convalescente con elevati titoli anticorpali neutralizzanti il virus vivo per l’immunoterapia anti-COVID-19”. Biologia delle comunicazioni 4,1 (2021): 1-9.
- Ripperger, Tyler J., et al. “I test sierologici ortogonali di SARS-CoV-2 consentono la sorveglianza delle zone a bassa prevalenza e rivelano un’immunità umorale resistente”. Immunità 53,5 ( 2020): 925-933.Ripperger, Tyler J., et al. “I saggi sierologici ortogonali per SARS-CoV-2 consentono la sorveglianza delle comunità a bassa prevalenza e rivelano un’immunità umorale duratura”. Immunità 53,5 (2020): 925-933.
- Kelley, Brian. “Sviluppo di anticorpi monoclonali terapeutici al ritmo della pandemia”. Biotecnologia naturale 38,5 ( 2020): 540-545.Kelley, Brian. “Sviluppo di anticorpi monoclonali terapeutici al ritmo della pandemia”. Biotecnologia della natura 38,5 (2020): 540-545.
- Heisler, E. e H. W. Vohr. "Modelli 3D di pelle umano/epidermico e sistemi di espianto di pelle organotipica umano e murina. Il riferimento enciclopedico dell’ipertossicologia." (2005).Heisler, E. e H. W. Vohr. "Modelli 3D di cute umana/epidermica e sistemi di espianto organotipico di cute umana e murina. Il riferimento enciclopedico dell’immunotossicologia.” (2005).
- Hu, Ping, et al. "Isolamento e analisi di singole celle." Frontiere nella biologia cellulare e dello sviluppo 4 ( 2016): 116.Hu, Ping, et al. "Isolamento e analisi di singole cellule". Frontiere nella biologia cellulare e dello sviluppo 4 (2016): 116.
- grosso, Andre, et al. "Tecnologie per l'isolamento di singole celle." Rivista internazionale di Scienze Molecolari 16,8 ( 2015): 16897-16919.Gross, Andre, et al. "Tecnologie per l'isolamento di singole cellule". Rivista internazionale di scienze molecolari 16,8 (2015): 16897-16919.
- Yim, Mandy e David Shaw. "Raggiungere una maggiore efficienza e una maggiore fiducia nel rivestimento a cella singola abbinando le tecnologie di stampa cellulare e di imaging a piastre". Avanzamento della biotecnologia 34,6 ( 2018): 1454-1459.Yim, Mandy e David Shaw. "Raggiungere una maggiore efficienza e una maggiore fiducia nella clonazione a cella singola combinando le tecnologie di stampa cellulare e di imaging a piastre". Progresso biotecnologico 34,6 (2018): 1454-1459.