Il ruolo degli anticorpi monoclonali contro la COVID-19
Scoprite perché i mAb sono un elemento fondamentale nella lotta contro il SARS-CoV-2 e in che modo la pandemia ha influenzato i loro processi di scoperta e sviluppo.
Nel corso degli ultimi tre anni, lo sviluppo di trattamenti per il COVID-19 ha guadagnato uno spazio notevole. La Vaccinazione è stata in prima linea nella guerra. Attraverso la somministrazione dell’mRNA, i vaccini spingono le cellule a produrre una versione innocua della proteina spike, stimolando quindi il sistema immunitario a produrre anticorpi per combattere la potenziale minaccia. La domanda è: cosa succede quando si è già contrattato il COVID-19 o il sistema immunitario è danneggiato in modo da essere ad alto rischio di ricovero anche dopo la vaccinazione. Questo è il punto in cui gli anticorpi monoclonali entrano prendendo di mira e neutralizzando il virus dopo che invade il corpo.
In primo piano il podcast
Nel nuovo podcast con Drug Target Review (Episodio 6 - mAbs e SARS-CoV-2 con il Dott. Carter Mitchell e il Dott. Sharath Madasu, Kemp Proteins), Carter Mitchell, Chief Scientific Officer e Sharath Madasu, Manager of Protein Characterization of Kemp Proteins, ha discusso il ruolo degli anticorpi monoclonali (mAb) contro COVID-19 e come la pandemia ha plasmato la loro scoperta e sviluppo.
Recensione del target del farmaco · Episodio 6 - mAbs e SARS-CoV-2 con il Dr. Carter Mitchell e il Dr. Sharath Madasu, Kemp Proteins
Sommario
Perché i mAb sono efficaci contro il SARS-CoV-2?
Gli anticorpi monoclonali (mAb) agiscono sui virus attraverso la neutralizzazione virale. Sono efficaci perché interrompono il processo mediante il quale il virus riconosce l’ospite o il virus viene internalizzato.
Meccanismo di lavoro degli anticorpi monoclonali
In SARS-CoV-2, l’obiettivo è quello di interrompere il legame della proteina spike con i recettori dell’ACE2, vietando l’ingresso del virus nelle cellule ospite. La proteina spike media il legame attraverso il suo dominio di legame di riconoscimento (RBD). Attualmente, la maggior parte degli anticorpi monoclonali neutralizzanti sono sollevati contro l’RBD.
Quanto sono efficaci gli anticorpi monoclonali contro le varianti di COVID-19?
Quando si tratta di efficienza, è difficile dare una singola risposta a causa del numero sempre maggiore di varianti. L’efficacia varia in base alle varianti. Ad esempio, sebbene la maggior parte degli anticorpi autorizzati per l’uso di emergenza funzioni sull’alfa e sulle varianti Delta, mostrano una minore efficacia nella variabile Omicron.
La difficoltà con Omicron è che ci sono almeno 36 mutazioni sulla proteina spike, alcune delle quali si trovano sull’RBD. Queste mutazioni provocano una glicosilazione differenziale, consentendo al virus di eludere le risposte immunologiche precedentemente formate o la neutralizzazione dell’anticorpo monoclonale.
Fortunatamente, gli anticorpi più recenti, come Sotrovimab, sono riusciti a mantenere la loro attività neutralizzante nelle recenti varianti, quindi c’è ancora uno scintillio di fiducia. Tuttavia, l’efficacia può variare molto. Alcuni anticorpi sono molto efficaci contro le varianti Alfa e Beta, ma non contro le varianti Gamma o Delta. Al contrario, gli anticorpi efficaci contro Delta e Alpha sono molto meno efficaci contro le varianti Beta, Gamma e Omicron.
L’impatto di una particolare mutazione della variante sull’EC50 dipende dal fatto che le mutazioni si trovino o meno nell’epitopo di legame.
I vantaggi dei mAb rispetto ad altre terapie anti-Covid-19
Il livello di certezza nel dosaggio richiesto è uno dei principali vantaggi degli anticorpali monoclonali nel trattamento del COVID-19.
Secondo il Dr. Madasu, il tasso di successo della terapia al plasma convalescente si basa pesantemente sul donatore. Madasu spiega ulteriormente: “Con la terapia al plasma convalescente, A) ci si aspetta che il Donatore stia ancora producendo gli anticorpi neutralizzanti, e B) Il Donatore sta producendo quantità sufficienti per essere efficace. Con gli anticorpi monoclonali, sappiamo esattamente quanto di un anticorpo neutralizzante stiamo somministrando al paziente, il che è un enorme vantaggio”.
La terapia con il plasma convalescente comporta anche un rischio notevole di incompatibilità del plasma tra i pazienti. L’uso di anticorpi monoclonali come metodo di trattamento efficace per il COVID-19 riduce significativamente questi rischi.
Il Dr. Mitchell sottolinea un’altra caratteristica degna di nota della terapia con mAb, la capacità di produrre un sottoinsieme di miscela pseudo policlonale che può neutralizzare qualsiasi tipo di variante che potrebbe emergere in futuro. Si potrebbe chiedere: Come possiamo essere così sicuri che questi anticorpi saranno efficaci contro le varianti future? Poiché ogni sottoinsieme ha uno specifico epitopo di legame, le mutazioni possono essere rapidamente riconoscete da uno o da una combinazione di sottoinsiemi di mAb.
Il Dr. Mitchell offre un esempio plausibile dei potenziali benefici delle miscele policlonali. “Tra cinque anni, se esce un nuovo tipo di variante, potremmo essere in grado di utilizzare un anticorpo monoclonale sollevato contro il tipo selvatico PIÙ uno che è entrato 2023 come terapia combinata per avere più efficacia contro quella particolare variante”.
L’effetto di un’improvvisa pandemia
Lo sviluppo di un anticorpale monoclonale si è innegabilmente spostato in avanti. La domanda rimane: I progressi nella produzione di anticorpi monoclonali sarebbero ancora avvenuti se non fosse stato per la pandemia di COVID-19?
Anche se il processo per lo sviluppo di un anticorpo monoclonale era già stato istituito, la pandemia ha creato un senso di urgenza. Il Dr. Madasu ritiene inoltre che le persone abbiano una comprensione più facile/migliore delle terapie anticorpali rispetto a quella dei vaccini. Durante la fase iniziale della pandemia, non era chiaro quanto sarebbe stato efficace un vaccino, quindi alcune sezioni di persone potrebbero aver esitato a prendere il vaccino. D’altro canto, le persone avevano un maggiore senso di comprensione per gli anticorpi, quindi le terapie a base di anticorpi erano più comunemente accolte.
La pandemia non solo ha accelerato il miglioramento delle strategie esistenti, ma ha anche spinto lo sviluppo di nuove tecniche. Tecnologie come la risonanza plasmica di superficie ad alto rendimento (SPR), l’interferometria a strato biologico ad alto rendimento (BLI), hanno guadagnato interesse durante la pandemia. Inoltre, anche rendimento DLS (Dynamic Light-scattering) e FLD sono migliorati molto. Una delle più recenti tecnologie è stata la progettazione di un anticorpo monoclonale de novo basato sull’intelligence artificiale, che ha aumentato la velocità e la complessità delle piattaforme di individuazione degli anticorpi .
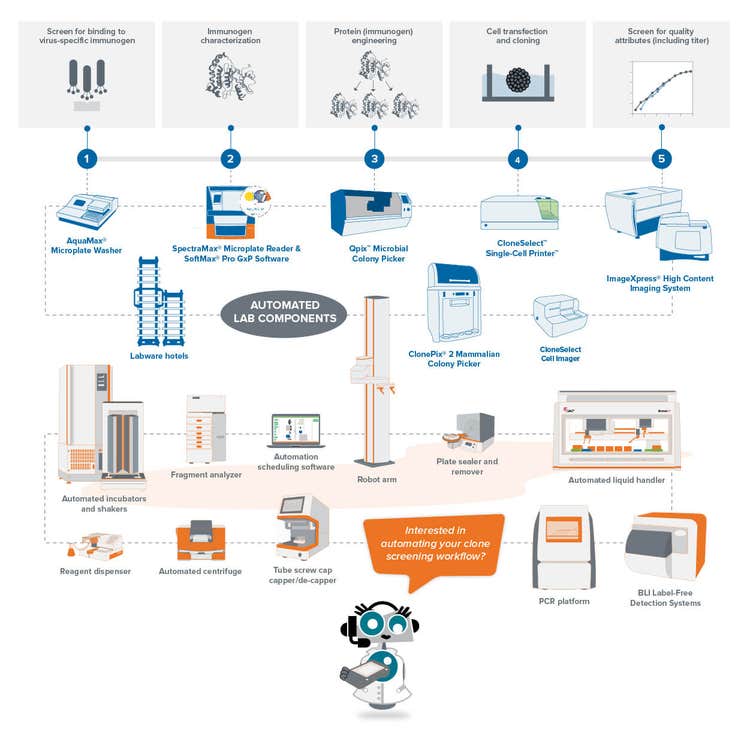
Flusso di lavoro per l’anticorpo monoclonale anti-COVID-19
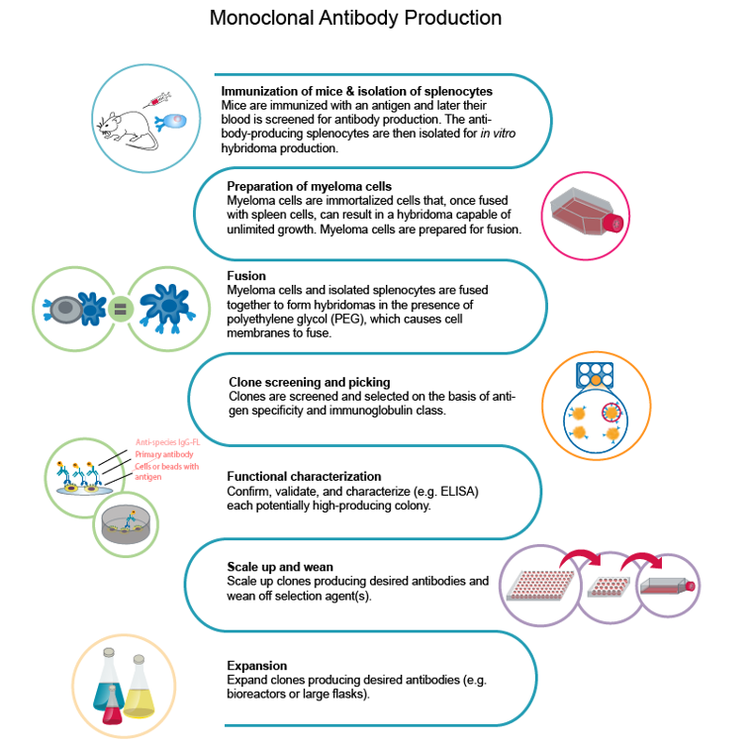
Il primo passo per costruire il flusso di lavoro è scegliere l'antigene da utilizzare per lo sviluppo di anticorpi monoclonali . Nella fase iniziale, l’immunizzazione si verifica mediante la somministrazione dell’antigene in un animale che sviluppa una risposta immunitaria. Quindi, le cellule beta generate durante la risposta immunitaria dell’animale vengono isolate, seguite da fusione con una cellula del mieloma per generare l’ibridoma.
Secondo il Dr. Mitchell, la chiave per una fase iniziale di successo è l'ottimizzazione dell'antigene. “In caso di COVID-19, gli anticorpi sono principalmente aumentati contro la proteina spike, che è un trimer. La proteina spike ha la tendenza a formare aggregati ad alto peso molecolare, che potrebbero non essere grandi per la strategia di immunizzazione”.
A questo scopo, i modelli di glicosilazione della proteina spike variano molto tra i tipi di cellule, per non parlare delle diverse specie.
Ecco perché è necessario prestare molta attenzione alla selezione dell’antigene. Anche una leggera deviazione di un singolo glicano dell'antigene (ad es., in diverse varianti) può influire significativamente sul tasso di successo dell'anticorpo.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonal-antibody-production
Sfide e colli di bottiglia
Immunizzazione
Una delle principali difficoltà è la comprensione del genoma virale. I team di ricerca di solito dovevano sintetizzare e Purificare gli antigeni e ottimizzare la loro espressione. Tuttavia, per valutare il successo dell’espressione e della depurazione, hanno dovuto fare riferimento alla natura collaborativa degli esperti per pubblicare le informazioni dai propri laboratori. Nel complesso, l’immunizzazione di un animale e la generazione del solo ibridoma potrebbero richiedere fino a otto settimane.
Isolamento a cella singola
Dopo aver identificato l’antigene di migliore qualità per la strategia di immunizzazione, la sfida successiva è ottenere un numero sufficiente di cellule B per l’isolamento a cellule singole dell’ibridoma.
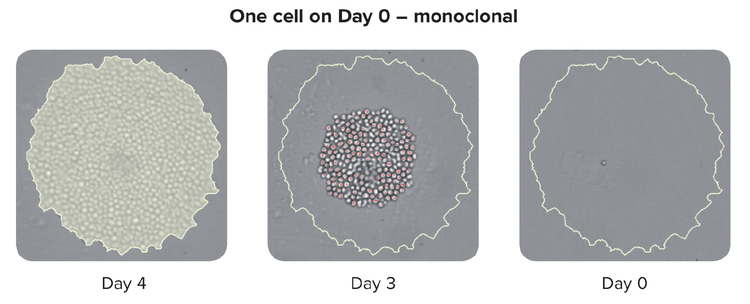
Il metodo tradizionale per coltivare questi ibridomi è un mezzo semi-solido che consente alla singola cellula di formare una colonia. Questo era un processo lento, ma da allora è diventato più importante con strumenti robotizzati che consentono la stampa di singole celle in ciascun pozzetto di una piastra a micropozzetti, aumentando sia la rendimento che l’efficienza.
È importante notare che gli strumenti avanzati di isolamento a singola cellula forniscono anche una maggiore efficienza di crescita clonale e la verifica della linearità che la colonia è stata generata da una singola cellula.
Naclonalità su larga scala
Per la linearità su larga scala, è necessario generare la forma ricombinante di un ibridoma isolato da una singola cellula perché l’isolamento di una singola cellula non è sufficiente per la generazione di mAb rilevanti dal punto di vista clinico. L’approvazione per le sperimentazioni cliniche richiederebbe la generazione ricombinante del mAb e della sua composizione in un anticorpo umano che consenta la risposta immunologica appropriata.
Per formare linee cellulari stabili per generare mAb a concentrazioni sufficienti, è necessario sequenziare e manipolare il gene in un costrutto umano. Le linee cellulari CHO vengono utilizzate per la generazione ricombinante, con lo scopo di 8-20 produzione di mAb g/L.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Vincoli di tempo e finanziari
Tempo e costi sono fattori chiave da considerare nei flussi di lavoro mAb
Anche se la generazione di cloni stabili può essere ottenuta in 12 giorni dall’avanzamento iniziale, la completa garanzia monoclonale potrebbe richiedere fino a sei mesi con i metodi di cloning tradizionali. Ancora più importante, generare una struttura mAb completamente realizzata può essere costoso. La soluzione sarebbe quella di formare degli anticorpi contro i frammenti variabili a catena singola o dei nanoanticorpi VHH. Questi sono i più piccoli frammenti anticorpali possibili che mostrano una specifica affinità di legame per un antigene. Il Dr. Mitchell riassume il motivo per cui questo approccio è così potente:
“Convertendo i mAb in nanobody più piccoli, possiamo produrli in E. coli in modo molto più conveniente. Questo riduce i costi, rendendolo un prodotto terapeutico largamente applicabile rispetto a quelli accessibili solo nei Paesi avanzati”.
Secondo il Dr. Madasu, le loro strutture stabili rendono più facile la distribuzione in Paesi meno sviluppati. “Dobbiamo pensare ad altri Paesi meno avanzati senza accedere alle strutture di stoccaggio. Alcuni di questi nanobody sono abbastanza stabili e potrebbero essere conservati in condizioni meno rigorose”.
Chiaramente, la conversione da anticorpo a corpo è un passo fondamentale per distribuire le terapie a base di mAbs in tutto il mondo a un costo inferiore. Soprattutto nei Paesi meno sviluppati con strutture di stoccaggio insufficienti, i nano-body sarebbero ancora stabili a temperature estreme.
Assicurare la monoclonalità e accelerare la produzione di mAb per il COVID-19 con l’automazione
Garanzia di monoclonalità
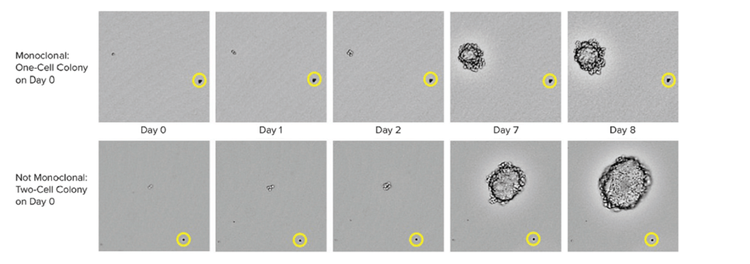
I metodi per garantire la linearità su larga scala includono le tecnologie automatiche come la stampa a celle singole o il prelievo di colonie. Quando si preleva una colonia isolata dal terreno HAT, lo strumento scatta immagini in un intervallo di tempo dal giorno zero dopo aver prelevato la colonia. La prova del testimone oculare costituisce una prova di linearità. Per garantire che i laboratori di cloni ad alte prestazioni possano utilizzare test basati su cellule o basati sul sistema immunitario combinati con metodi basati su immagini. Questa strategia combinata assicura che si abbia una monoclonalità e che i cloni stiano secernendo una singola varietà di anticorpi. Come fase finale del processo, è anche utile eseguire dei test di legame dell'epitopo per determinare se il legame dell'epitopo è uniforme.
https://main--moleculardevices--hlxsites.hlx.page/applications/monoclonality
Il ruolo della robotica nel tempo di risposta
Il modo finale per ridurre la cronologia di sviluppo è quello di implementare robot ad alta rendimento per interrogare i cloni. Nei flussi di lavoro dei mAb automatici per il COVID-19, la depurazione automatica ha fornito un enorme aiuto per comprendere il comportamento dei cloni e la possibilità che l’anticorpo monoclonale generi un elevato peso molecolare.
L’utilizzo della robotica in un modo ad alta rendimento è sempre un vantaggio nel portare sul mercato nuovi prodotti terapeutici, questo metodo fornisce una migliore panoramica dello spazio proteico o dello spazio degli epitopi. Avere un elevato numero di cloni aumenta al massimo le possibilità di ottenere mAb che coprono tutti gli attributi desiderati invece di avere un singolo mAb con copertura parziale dell'antigene.
Con i flussi di lavoro ad alta rendimento, si può restringere la concentrazione in un sottoinsieme di monocloni con il rendimento più elevato. È quindi possibile andare avanti con i sottoinsiemi di più alto grado per eseguire ulteriori valutazioni in studi sugli animali e test di tossicologia. Si risparmierebbe anche tempo eliminando i sottoinsiemi non adatti per la depurazione su larga scala, che impedisce lo scarico economico durante il percorso di ricerca per il COVID-19 del laboratorio.
Automazione dei processi di laboratorio mAb in futuro
Molti laboratori di ricerca per il COVID-19 hanno già implementato processi automatici da quando sono in grado di generare dati per migliaia di cloni alla settimana. La comprensione dei meccanismi terapeutici dei mAb è molto più probabile con la sintesi, l’espressione, la depurazione e la caratterizzazione biofisica automatiche.
Ancora più importante, l'automazione apre la strada ai metodi di analisi imparziali e ai criteri di selezione. L’analisi oggettiva è necessaria per diversificare la libreria di anticorpi per una vasta gamma di varianti e mutazioni per evitare di ridimensionare gli anticorpi che trattano solo una stretta serie di varianti.
Futuro della ricerca su SARS-CoV-2 e il ruolo degli anticorpi monoclonali
Le terapie a base di mAb sono disponibili sul mercato degli Stati Uniti sin dalla prima autorizzazione dell1986’mAb da parte dell’FDA per lo sviluppo di muromonab-CD3 (Orthoclone OKT3) per ridurre il rigetto acuto nei pazienti con trapianti di organo. (1) L’attuale ricerca sul COVID-19 aumenta la importanza degli anticorpi monoclonali anche nella diagnostica. In effetti, gli anticorpi monoclonali hanno giocato un ruolo fondamentale nel rilevare le varianti di SARS-CoV-2.
Oltre alla diagnostica, gli attuali mAb aiutano i ricercatori a determinare le modifiche necessarie e persino a informare lo sviluppo di candidati al vaccino. Nell’indagare se un mAb di riferimento possa neutralizzare una variante del virus, i ricercatori possono decidere se sviluppare nuove terapie più efficienti.
Mentre i vaccini a base di mRNA sono stati al centro della guerra contro il COVID-19, gli anticorpi monoclonali sono stati dietro le quinte di varie applicazioni, dai vaccini a base di proteine alle terapie a base di anticorpi.
Il Dr. Madasu e il Dr. Mitchell ritiene che in futuro, potrebbero essere applicati degli anticorpi monoclonali in particolare alla popolazione non vaccinata, inclusi i lattanti, i pazienti con comorbidità (che non rispondono bene ai vaccini) e le persone che esitano a essere vaccinate. Come accennato in precedenza, la chiave è quella di produrre prodotti terapeutici a base di mAb dal costo contenuto e di renderli il più disponibili possibile, aumentando l’efficienza nel processo di ricerca e produzione.
Scoperta di un anticorporeo per il COVID-19 con le soluzioni di automazione di laboratorio di Molecular Devices
Lo screening del clone è uno dei colli di bottiglia della ricerca di un analizzatore di anticorpi monoclonali perché è necessario testare e analizzare migliaia di cellule in relazione all’antigene target. I flussi di lavoro automatici di selezione dei cloni possono aiutare a superare questo peso riducendo i tempi di preparazione manuale e unificando e standardizzando i dati estratti da più processi.
La divisione Dispositivi Molecolari ha costruito soluzioni di flusso di lavoro integrate per i passaggi essenziali. I flussi di lavoro automatici per lo sviluppo di linee cellulari puntano a produrre linee di cellule monoclonali che producano livelli costanti e sufficienti della proteina terapeutica target. Il flusso di lavoro automatizzato della clonazione molecolare cerca di ridurre al minimo gli errori e la contaminazione durante l’isolamento delle sequenze di DNA, che vengono propagate come vettori nelle specie di vostra scelta.
Questi flussi di lavoro ottimizzano la resa delle proteine target, offrendo al contempo l'opportunità di integrare altri strumenti per una cella di lavoro completamente automatica con la robotica. Nel complesso, questi flussi di lavoro sono efficienti dal punto di vista dei costi, consentono di risparmiare tempo e sono facili da modificare con la modifica degli obiettivi di ricerca.
Nella nostra pagina Automazione del laboratorio per lo screening del clono ad alta rendimento, è possibile per saperne di più informazioni sui flussi di lavoro di sviluppo delle linee cellulari in modo più approfondita. Non dimentichi di consultare la nostra pagina di applicazione dell’antibiogramma per visualizzare i metodi di produzione di mAb e le complessità di ogni passo coinvolto.
- Wang, S. S., Yan, Y. S., & Ho, K. ( 2021). Anticorpi terapeutici approvati dalla US FDA con composizione ad alta concentrazione: riepiloghi e punti di vista. Farmaci anticorpali , 4(4), 262–272. https://doi.org/10.1093/abt/tbab027