IL FUTURO DELLA
BIOLOGIA COMPLESSA
Il sistema automatizzato di coltura cellulare CellXpress.ai
Vedi la differenza. Scegli il meglio. Sistemi di prelievo di colonie microbiche QPix FLEX
Approfondimento dettagliato: ImageXpress HCS.ai Sistema di screening ad alto contenuto con approfondimenti basati sull’IA
Lettori per micropiastre SpectraMax® e software SoftMax® Pro leader del settore
Promuoviamo il progresso delle scoperte scientifiche
La nostra priorità è quella di dotare i ricercatori di una tecnologia di nuova generazione, ispirando soluzioni innovative che facciano progredire le scoperte scientifiche, per migliorare la qualità della vita umana in tutto il mondo.
Un’azienda specializzata in scienze della vita
Quarant’anni dedicati a rendere possibili i laboratori di scienze della vita del futuro, in cui confluiscono tecnologie all’avanguardia e ricerche innovative.


Cella di lavoro automatizzata per imaging 3D all’avanguardia
Il Centro di innovazione sugli organoidi di Molecular Devices combina tecnologie all’avanguardia con innovativi metodi di ricerca per affrontare le principali problematiche associate alla scalabilità dei modelli biologici 3D complessi.
Questo spazio collaborativo permette a clienti e ricercatori di recarsi nel laboratorio per testare flussi di lavoro automatizzati per la coltura e lo screening degli organoidi, sotto la guida di scienziati dell’azienda.
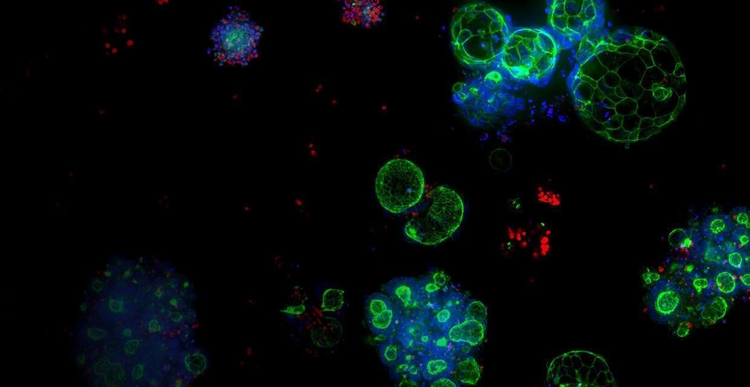
Biologia 3D
Aprire la strada a un nuovo futuro della scoperta farmacologica che ha origine dalla biologia 3D consentirà ai ricercatori di personalizzare le terapie, ridurre le tempistiche di commercializzazione dei farmaci e migliorare la qualità della vita dei pazienti di tutto il mondo.
Lo sfruttamento della tecnologia brevettata dei bioprocessi per produrre organoidi affidabili e predittivi su larga scala e l’innovazione del sistema di coltura cellulare del futuro ci rendono fiduciosi nei confronti delle rivoluzionarie potenzialità della biologia 3D.

Ingegneria cellulare
L’aggiunta della nostra piattaforma per il prelievo di colonie amplia le metodologie e le tecnologie all’avanguardia del Centro con l’inclusione di flussi di lavoro automatizzati per la biologia sintetica, la scoperta di anticorpi e lo sviluppo di linee cellulari.
E, con la recente introduzione dell’imager CloneSelect® FL con fluorescenza multicanale per la verifica della monoclonalità al giorno zero e la conferma delle modifiche eseguite con la tecnologia CRISPR, offre un’ampia varietà di applicazioni nel campo della terapia genica e cellulare.
Automazione e personalizzazione per il laboratorio

Dal personale di supporto tecnico con formazione accademica di alto livello ai tecnici dell’assistenza certificati e addestrati da esperti, guidiamo gli scienziati alla scoperta di soluzioni di automazione personalizzate concepite appositamente per soddisfare le esigenze specifiche del loro saggio, metodo o protocollo.
Scoprite le nostre soluzioni integrate end-to-end di screening ad alto rendimento
Screening ad alto contenuto automatizzato
Forniamo agli scienziati gli strumenti necessari per fare progressi nelle loro scoperte
Le soluzioni automatizzate complete abbracciano campi di ricerca diversi per aiutare gli scienziati a scoprire, ampliare e industrializzare il mondo della biologia.

Lettori per micropiastre facili da usare, intuitivi e configurabili
Collaboriamo con i ricercatori da oltre 40 anni per ampliare i confini delle loro ricerche. I nostri lettori per micropiastre SpectraMax e il software SoftMax Pro sono i più citati del settore e hanno permesso ai ricercatori nel campo delle scienze naturali di compiere progressi in biologia cellulare e proteica, infrangendo le barriere e proiettandosi verso nuove fondamentali scoperte.

Ottimizzate il vostro percorso per la conformità GxP nei laboratori GMP/GLP
Siamo un’azienda leader nel campo delle soluzioni complete per la conformità GXP che, grazie alla combinazione di lettori per micropiastre SpectraMax®, software SoftMax® Pro GxP, piastre di validazione SpectraTest® e servizi specializzati di IQ/OQ/PM, aiuta i laboratori che operano ai sensi delle norme GMP e GLP a osservare le linee guida normative locali o quelle dell’FDA in totale sicurezza.
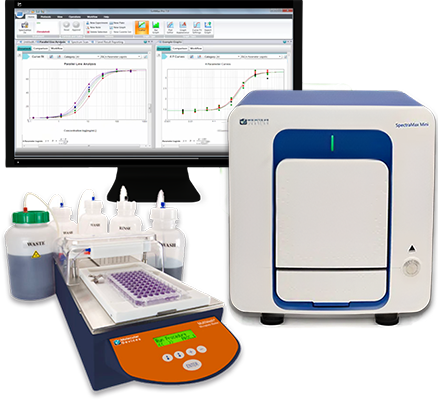
Risparmiate con un pacchetto: Lettore per micropiastre + lavatrice
La soluzione automatizzata costituita da un lettore per micropiastre e una lavatrice consente di migliorare l’efficienza del laboratorio, ottenere una maggiore quantità di dati e ridurre il tempo necessario per ottenere risultati di successo:
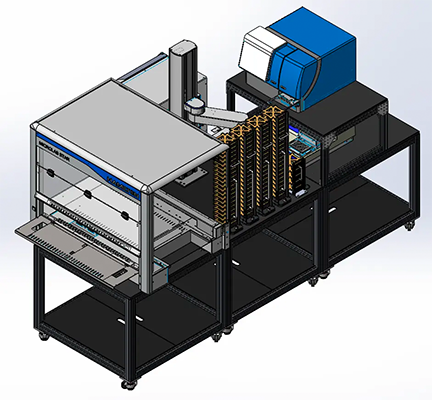
Automazione di laboratorio per saggi ad alto rendimento basati su piastre
Scoprite le nostre soluzioni automatizzate e totalmente integrate per i flussi di lavoro per saggi biochimici e basati su cellule. Le nostre celle di lavoro ELISA ampliabili consentono di avere tempo per dedicarsi ad altro, aumentando il rendimento, l’efficacia e l’efficienza della procedura del saggio e la riproducibilità.

Lettori per micropiastre facili da usare, intuitivi e configurabili
Collaboriamo con i ricercatori da oltre 40 anni per ampliare i confini delle loro ricerche. I nostri lettori per micropiastre SpectraMax e il software SoftMax Pro sono i più citati del settore e hanno permesso ai ricercatori nel campo delle scienze naturali di compiere progressi in biologia cellulare e proteica, infrangendo le barriere e proiettandosi verso nuove fondamentali scoperte.

Ottimizzate il vostro percorso per la conformità GxP nei laboratori GMP/GLP
Siamo un’azienda leader nel campo delle soluzioni complete per la conformità GXP che, grazie alla combinazione di lettori per micropiastre SpectraMax®, software SoftMax® Pro GxP, piastre di validazione SpectraTest® e servizi specializzati di IQ/OQ/PM, aiuta i laboratori che operano ai sensi delle norme GMP e GLP a osservare le linee guida normative locali o quelle dell’FDA in totale sicurezza.

Automazione di laboratorio per saggi ad alto rendimento basati su piastre
Scoprite le nostre soluzioni automatizzate e totalmente integrate per i flussi di lavoro per saggi biochimici e basati su cellule. Le nostre celle di lavoro ELISA ampliabili consentono di avere tempo per dedicarsi ad altro, aumentando il rendimento, l’efficacia e l’efficienza della procedura del saggio e la riproducibilità.


Sistema di screening ad alto contenuto ImageXpress® HCS.ai per un’analisi dei dati di qualità superiore e approfondimenti basati sull’IA
Si distingue per il suo disegno avanzato e modulare e per la capacità di acquisire rapidamente immagini estremamente chiare di modelli cellulari complessi, acquisire dati dettagliati con un software intuitivo e offrire approfondimenti grazie all’analisi guidata dall’intelligenza artificiale.


Presentiamo il rivoluzionario sistema di coltura cellulare automatizzato CellXpress.ai™
Il sistema CellXpress.ai, un innovativo hub per la coltura cellulare basato su intelligenza artificiale, automatizza i processi, migliora i flussi di lavoro e rende i saggi più affidabili e riproducibili grazie al monitoraggio, all’alimentazione, all’imaging e alla programmazione assistiti dall’apprendimento automatico.
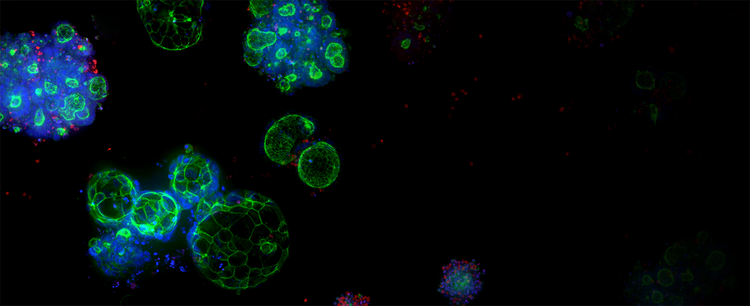
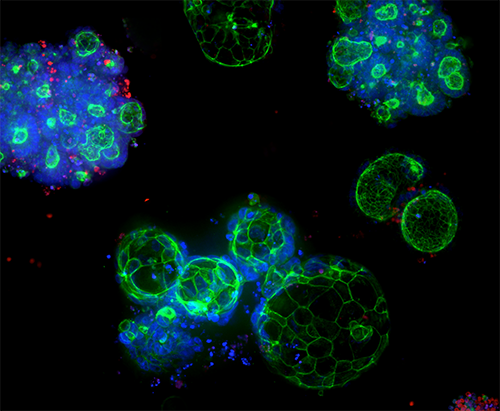
Organoidi 3D Ready e servizi di espansione degli organoidi
Gli organoidi di qualità controllata sono prodotti su larga scala per lo screening ad alto rendimento, sfruttando la tecnologia brevettata dei bioreattori e dei bioprocessi per produrre organoidi derivati da pazienti (Patient-Derived Organoids, PDO) affidabili e predittivi.

Il sistema di selezione di colonie microbiche QPix® FLEX™ per la precisione, la flessibilità e gli ambienti con spazio limitato.
Semina in piastre, streaking, selezione e gestione dei liquidi, tutto in un unico dispositivo compatto? Con il sistema di prelievo di colonie microbiche QPix FLEX, tutto sembra più semplice. Grazie all’imaging avanzato a colori, vi aiuta a individuare più rapidamente le colonie giuste. E sì, si adatta al banco o a una camera ipossica: come potrebbe essere altrimenti? Il sistema QPix FLEX sostituisce il disordine con un sistema intelligente e semplificato, realizzato per consentirvi di dedicarvi al progresso della vostra ricerca.

Sistemi di screening di cloni per il prelievo di colonie e l’isolamento di singole cellule
Il sistema di prelievo di colonie microbiche QPix® 400, il sistema di prelievo di colonie di cellule di mammifero ClonePix® 2 e l’imager CloneSelect® FL aumentano il rendimento e la coerenza tra lo sviluppo di linee cellulari, la scoperta di anticorpi monoclonali e i flussi di lavoro inerenti alla biologia di sintesi.

Soluzioni automatizzate per lo screening di cloni ad alto rendimento
Soluzione per l’automazione del laboratorio totalmente integrata per il clonaggio molecolare, la scoperta di anticorpi e la monoclonalità. I nostri flussi di lavoro automatizzati per lo screening di cloni integrano dispositivi di laboratorio per aumentare il rendimento e l’efficienza, riducendo al tempo stesso la necessità di intervento umano.

Dispensazione e screening di singole cellule per la verifica della monoclonalità.
Il pluripremiato dispensatore per cellule singole DispenCell™ e CloneSelect® Imager FL - la nostra soluzione combinata offre una precisione e un’efficienza senza pari nello sviluppo di linee cellulari e nella verifica della monoclonalità al giorno zero.

Sistemi di screening di cloni per il prelievo di colonie e l’isolamento di singole cellule
Il sistema di prelievo di colonie microbiche QPix® 400, il sistema di prelievo di colonie di cellule di mammifero ClonePix® 2 e l’imager CloneSelect® FL aumentano il rendimento e la coerenza tra lo sviluppo di linee cellulari, la scoperta di anticorpi monoclonali e i flussi di lavoro inerenti alla biologia di sintesi.

Soluzioni automatizzate per lo screening di cloni ad alto rendimento
Soluzione per l’automazione del laboratorio totalmente integrata per il clonaggio molecolare, la scoperta di anticorpi e la monoclonalità. I nostri flussi di lavoro automatizzati per lo screening di cloni integrano dispositivi di laboratorio per aumentare il rendimento e l’efficienza, riducendo al tempo stesso la necessità di intervento umano.
Siamo scienziati che supportano scienziati
Forniamo agli scienziati gli strumenti necessari per fare progressi nelle loro scoperte, favorendo diagnosi più precoci e lo sviluppo di composti terapeutici più sicuri per i pazienti.

Biologia 3D: Il cambiamento di paradigma nella scoperta farmacologica di nuova generazione
Nel corso dell’evoluzione di un paradigma per la scoperta farmacologica, i ricercatori di tutto il mondo stanno cambiando lo screening di composti da colture cellulari e modelli animali 2D a sistemi 3D più complessi e rilevanti per l’uomo, come gli organoidi. Scoprite con la nostra infografica interattiva perché il settore sta accogliendo questa nuova generazione di scoperta farmacologica e le innovazioni che supportano i ricercatori nel loro percorso nella biologia 3D.
Scoperta e sviluppo di farmaci
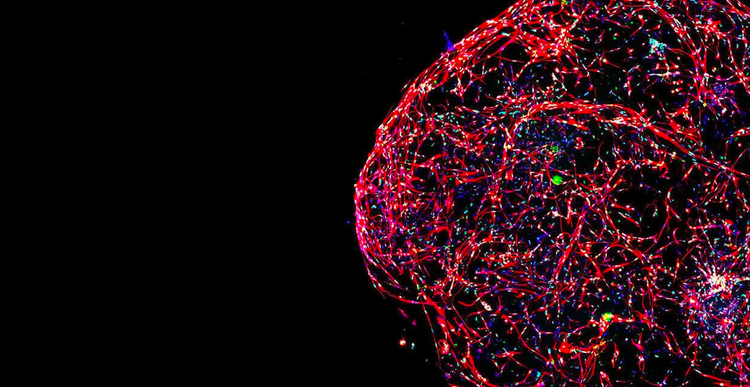
Lo scenario della scoperta farmacologica sta cambiando e un numero crescente di scienziati incentra lo sviluppo di linee cellulari, i modelli di malattia e i metodi di screening ad alto rendimento su modelli cellulari 3D fisiologicamente rilevanti.
Il motivo di questo approccio è chiaro: utilizzando nella ricerca sistemi cellulari modello in grado di riprodurre fedelmente gli stati patologici dei pazienti o gli organi umani, è possibile accelerare l’immissione sul mercato di composti terapeutici salvavita.
Modelli cellulari 3D
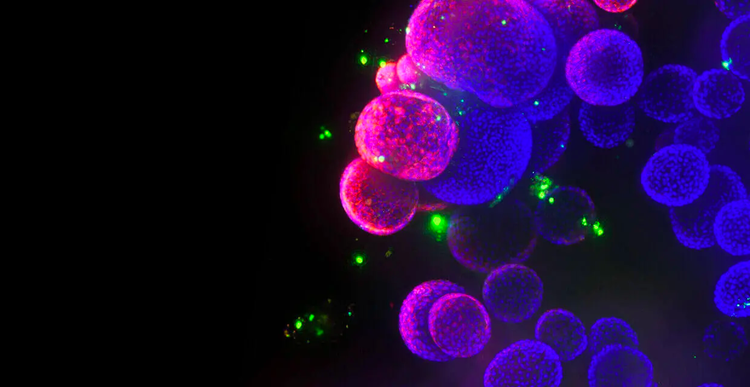
Con le nostre soluzioni automatizzate di coltura cellulare 3D e screening per il bioimaging, contribuiamo a ridefinire il futuro della scoperta farmacologica. Grazie al supporto della nostra tecnologia e dei nostri protocolli per lo sviluppo di organoidi, i ricercatori possono adesso migliorare e ampliare i metodi di screening per mettere a punto modelli 3D fisiologicamente rilevanti in grado di riprodurre più fedelmente gli stati patologici dei pazienti e gli organi umani, accelerando lo sviluppo e l’approvazione dei farmaci.
Sviluppo di linee cellulari
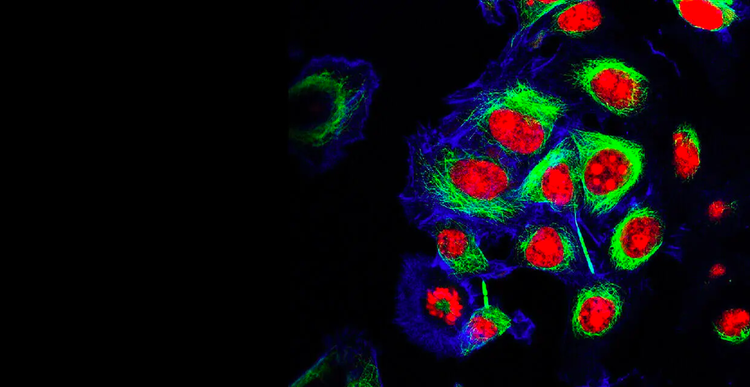
I nostri clienti impegnati nello sviluppo di linee cellulari velocizzano i tempi necessari per l’immissione sul mercato di prodotti della medicina genomica e anticorpi monoclonali (mAb) salvavita e realizzano ricerche rivoluzionarie nel campo delle terapia genica e cellulare, dell’ingegneria genetica, della medicina personalizzata e di precisione, della biologia sintetica e dei vaccini basati sul DNA e sull’RNA e in un’ampia gamma di altre aree, il tutto grazie alla nostra tecnologia innovativa e alla nostra vasta esperienza.
Screening farmacologico
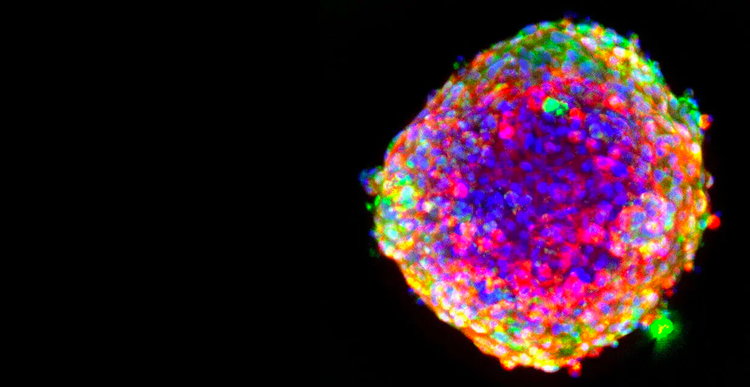
Per ogni farmaco che arriva alla meta, ce ne sono nove che non hanno successo. Questo allarmante tasso di insuccesso è riconducibile al ricorso a colture cellulari 2D che non sono in grado di riprodurre fedelmente la complessa biologia umana, determinando spesso previsioni imprecise in merito al potenziale di un farmaco e tempi di sviluppo prolungati.
Lo screening dei farmaci e la valutazione della tossicità rappresentano una fase critica nel processo di scoperta farmacologica, svelando gli effetti di composti potenzialmente in grado di salvare vite umane. Il passaggio ai saggi basati sulle cellule consente di testare con rapidità più composti chimici e rappresenta in modo migliore la fisiologia umana.





