
Suggerimenti per eseguire nel modo migliore un esperimento di imaging su cellule vive
Nell’ultimo decennio sono stati compiuti progressi significativi nel campo della microscopia e della tecnologia delle videocamere e le tecniche di marcatura delle molecole di interesse si sono notevolmente evolute. Questi avanzamenti hanno portato a una maggiore diffusione dell’imaging delle cellule viventi in una varietà di campi, dalla ricerca di base, agli studi avanzati in neurobiologia, biologia dello sviluppo, ricerca sul cancro e sviluppo di farmaci. In questi campi, l’imaging di cellule viventi può essere utilizzato per esaminare i processi cellulari che si verificano in un periodo di tempo che va dall’intero livello di organismo fino al livello molecolare.
Anche se ci sono molte applicazioni per l'imaging di celle vive e molti metodi di microscopia diversi che possono essere utilizzati, una difficoltà comune è mantenere l'integrità del campione durante il corso dell'esperimento, durante l'acquisizione di immagini con una risoluzione sufficiente. Questi due fattori sono fondamentali per ottenere dati rilevanti e riproducibili dai tuoi esperimenti di diagnostica per immagini con cellule viventi.
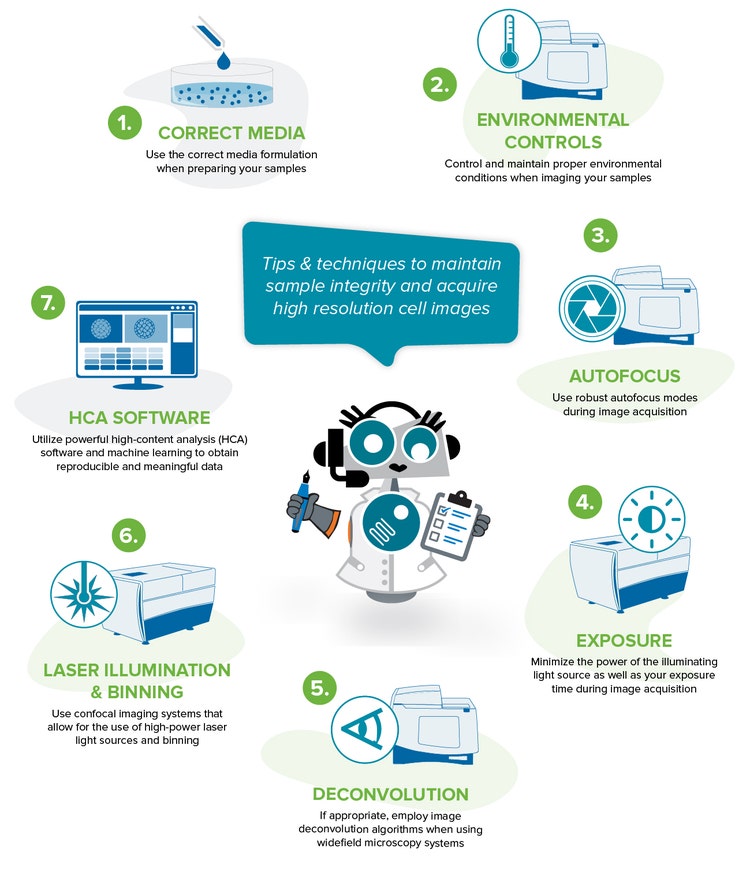
Best practice per ottenere dati rilevanti e riproducibili
Di seguito sono riportati alcuni suggerimenti e tecniche per aiutare a mantenere la salute del campione ed eseguire un esperimento di diagnostica per immagini di successo.
1. Utilizzare la corretta composizione del supporto durante la preparazione dei campioni
Oltre a garantire che le formulazioni dei supporti contengano i principi nutritivi appropriati per coltivare la crescita e lo sviluppo delle cellule, tenere conto di fattori come il pH, la capacità di buffering e l’osmolarità sono fondamentali per l’esecuzione di un esperimento di diagnostica per immagini con cellule viventi di successo. Le variazioni nel pH e nell’osmolarità del supporto (cioè la quantità di soluto all’interno della soluzione del supporto) possono influenzare l’espressione delle cellule, il loro fenotipo e infine influenzare il loro aspetto e comportamento. La regolazione e il mantenimento di condizioni ambientali ottimali aiuterà a prevenire modifiche indesiderate o dannose ai supporti.
Inoltre, ci sono molti fattori all'interno dei supporti che possono contribuire all'autofluorescenza del nostro elevato segnale di sfondo all'interno delle immagini. Considerare l'utilizzo di supporti privi di rosso fenolo e la riduzione della concentrazione del siero. Questo ridurrà enormemente il segnale di sfondo.
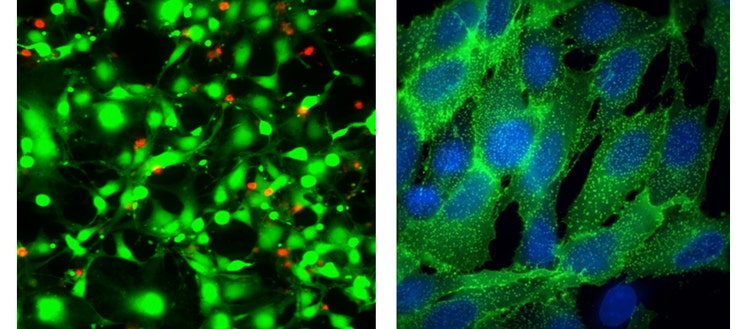
Sinistra: Immagine Apo del piano 40X delle cellule HeLa trattate con straurosporina per 18 ore e quindi colorate con il test EarlyToxý Live Dead – calceina AM (verde) ed etidium homodimer-III (rosso)
Destra: Immagini 100X Plan Apo (aria) di Transfluor U2OS trattate con isoproterenolo per stimolare l’internalizzazione del recettore, che viene visualizzata mediante ß-arrestina (verde) marcata con GFP. Le cellule sono state controcolorate con la colorazione 33342 nucleare di Hoechst.
2. Controllare e mantenere condizioni ambientali corrette durante l'acquisizione di immagini dei campioni
È importante mantenere condizioni ambientali adeguate per i campioni per tutta la durata dell'esperimento di imaging delle cellule viventi. I controlli ambientali includono temperatura, umidità e gas (ad es., ossigeno e ossido di carbonio).
La capacità di regolare e conservare una temperatura stabile non solo mantiene la salute cellulare, ma riduce anche il rischio di deriva della messa a fuoco. La deriva della messa a fuoco è l'impossibilità di mantenere la messa a fuoco nel tempo. In genere è dovuto a variazioni di temperatura, che causano l'espansione e la trazione dei materiali utilizzati per realizzare la micropiastra o altri recipienti di coltura. Per ridurre ulteriormente il rischio di incontrare la deriva della messa a fuoco a causa di fluttuazioni termica, assicurarsi che la micropiastra sia posizionata sul piano dello strumento o nella camera di controllo ambientale per consentire l'equilibrazione termica prima di configurare le impostazioni di acquisizione. Inoltre, se il supporto deve essere aggiunto ai pozzi durante l'esperimento in time-lapse, assicurarsi che sia alla stessa temperatura del supporto nel recipiente di imaging. Le opzioni di controllo della fluidica integrata, o l'integrazione dell'automazione con i sistemi di movimentazione liquidi per le aggiunte di supporti e reattivi, aumenta la rendimento e riduce al minimo il rischio di contaminazione o disturbo delle celle attraverso l'intervento manuale.

Il mantenimento di un'umidità adeguata aiuta a prevenire l'evaporazione dei supporti, specialmente per gli esperimenti a lungo termine con cellule viventi. L'vaporazione causa cambiamenti dell'osmolarità che possono influire negativamente sul comportamento delle cellule e influire sul test. Se il controllo dell'umidità non è un'opzione, è possibile utilizzare una soluzione ipotonica (basso soluto).
Anche il controllo dei livelli di ossido di carbonio è importante, in quanto aiuta a regolare il pH all’interno del campione. Se non si è in grado di controllare i livelli di ossido di carbonio, ci sono diversi buffer sintetici, come HEPES, che possono essere utilizzati per mantenere il pH. Tuttavia, la compatibilità tra le celle di interesse e il buffer sintetico deve essere verificata prima dell'uso, in quanto i buffer sintetici possono essere nocivi per molti tipi di celle. Se le cellule sono compatibili, HEPES deve essere utilizzato per studi a breve termine che durano alcune ore, in quanto la manutenzione prolungata in supporti HEPES buffered potrebbe essere dannosa per le cellule.
Anche il mantenimento di livelli di ossigeno adeguati è fondamentale, in quanto i requisiti di ossigeno possono variare molto a seconda del tipo di cellula o dei requisiti del particolare esperimento di cellule vive.
Gli imager come il sistema di imaging cellulare automatico ImageXpress® Pico e il sistema di imaging ad alto contenuto ImageXpress® Confocal HT.ai includono una serie di opzioni di controllo ambientale per temperatura, umidità, ossigeno e ossido di carbonio. Poiché questi imager possono essere completamente integrati con un sistema di controllo ambientale chiuso, le piastre non sono esposti alla luce ambientale e ad altre condizioni di laboratorio esterne che potrebbero compromettere l'integrità del campione. Inoltre, il software dei sistemi ImageXpress consente di monitorare con precisione l’ambiente cellulare durante il corso dell’operazione tramite letture del sensore di controllo ambientale.
3. Utilizzare robusti modi di autofocus durante l'acquisizione dell'immagine
I nostri sistemi ImageXpress sono progettati con una varietà di modalità di autofocus hardware (laser e LED) e software (basate su immagini) che consentono di trovare e conservare le immagini di messa a fuoco tra un esperimento e l’altro e di ridurre al minimo la deriva della messa a fuoco. Le modalità autocentranti possono accogliere una vasta gamma di campioni, spessori dei recipienti di coltivazione, obiettivi e parametri di imaging.
I metodi di autofocus hardware funzionano per la maggior parte dei campioni e sono indipendenti dalla qualità e dalla luminosità del campione. L'autofocus hardware consente velocità di acquisizione più elevate, riducendo al minimo lo sbiancamento fotografico dei campioni. Quando la posizione Z del campione varia nel tempo o su una piastra, l'aggiunta di metodi di autocentratura software può aiutare a fornire una messa a fuoco affidabile su tutto il campione e gli utensili da laboratorio. Nella maggior parte dei casi in cui è necessaria una messa a fuoco basata su software, è necessario abilitare sia l’autofocus hardware che software. L'autofocus hardware troverà la piastra inferiore, il fondo del pozzetto o entrambe le superfici. Quindi l'autofocus software utilizzerà il contrasto dell'immagine per trovare il piano focale ideale. Pertanto, i campioni devono essere chiari e privi di detriti per consentire all'autofocus del software di funzionare in modo ottimale.
A differenza dell'autofocus hardware, l'autofocus software riduce le velocità di acquisizione ed esegue il rischio di campioni di fotosbiancamento. Per ridurre questo problema, l'autofocus software deve essere abilitato per il primo canale acquisito e la luce trasmessa può essere utilizzata come primo canale invece di un canale fluorescente. Inoltre, ridurre il tempo di esposizione e utilizzare fluorofori più luminosi e stabili. Utensili come il binning (vedere # 6) possono anche essere utilizzati per ridurre i tempi di esposizione.
I metodi di autofocus software devono essere utilizzati da soli solo solo quando l'autofocus hardware non è stato configurato per la piastra, l'autofocus hardware non riesce a causa di difetti della piastra, il basso volume nei pozzi riduce l'affidabilità dell'autofocus hardware o quando vengono utilizzati gli obiettivi di immersione dell'olio.
Il software di acquisizione e analisi delle immagini ad alto contenuto MetaXpress® consente agli utenti di configurare le impostazioni di autofocus per soddisfare le esigenze di un determinato test. Quando si eseguono velocemente degli esperimenti cinetici time-lapse in un singolo pozzetto, l'autofocus può essere applicato al primo punto temporale solo per aumentare la velocità di acquisizione. Per gli sperimenti time-lapse a lungo termine o quando la velocità di imaging non è fondamentale, l'autofocus può essere impostato su tutti i punti temporali per ridurre la deriva della messa a fuoco.
Nel software di acquisizione e analisi delle immagini CellReporter , è possibile abilitare una serie di routine di autofocus hardware e software. Ciascuno di essi è progettato per casi d'uso specifici, fornendo opzioni di messa a fuoco senza pari per una vasta gamma di campioni. Ad esempio, la routine di autofocus dell’hardware di inserto del pozzetto rileva tre picchi (piastra inferiore, pozzetto inferiore e pozzetto inserto) per un rilevamento rapido e una messa a fuoco ottimale per gli utensili da laboratorio che contengono tre superfici distinte. Per le acquisizioni che richiedono una maggiore velocità a basso ingrandimento, la routine Posizione di messa a fuoco ancoraggio mantiene la posizione Z in messa a fuoco selezionata, disabilita l'autofocus e acquisisce le immagini con questa posizione di messa a fuoco salvata. Ciò è particolarmente utile quando si lavora con campioni macroscopici come interi organismi o tessuti.
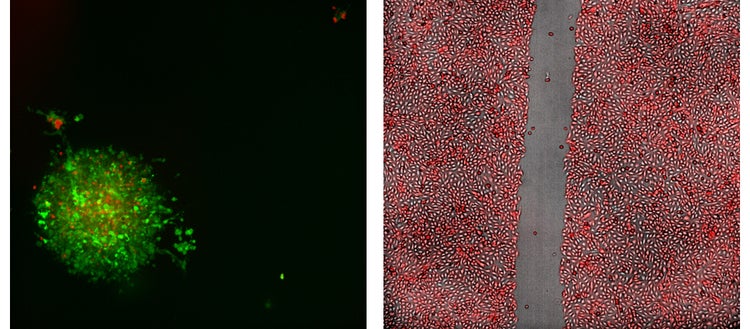
Sinistra: Immagine rappresentativa di proiezione 20X confocale, 2D da un test immuno-oncologico che mostra uno sferoide del tumore del colon di topo; realizzata con cellule MC38 che esprimono GFP, trattate con cellule T che esprimono RFP.
Destra: Immagine del test di guarigione della ferita 4X delle cellule Sigma U2OS che sono state stabilmente trasfette per espressione di RFP.
4. Ridurre al minimo la potenza della fonte luminosa illuminante e il tempo di esposizione durante l'acquisizione delle immagini
La potenza della sorgente luminosa illuminante e il tempo di esposizione possono causare fototossicità delle cellule. Anche piccole modifiche alle cellule possono influenzare il loro comportamento o l’espressione del gene. Pertanto, è necessario trovare il giusto bilanciamento, dove è possibile acquisire un'immagine di qualità senza esporre il campione a troppa luce.
In termini di illuminazione, quando un cloroforo o una mole fluorescente viene messo in uno stato di uscita, genera radicali liberi che possono causare danni al DNA e stress sulle cellule. Più alta è l’intensità della luce, più alto è lo stato di eccitazione, che può causare fototossicità o danni alle cellule. La luce a raggi UV (Ultraviolet) è nota per essere più fototossica, quindi l'uso di fluorofori eccitabili come DAPI può produrre più fototossicità, rispetto all'uso di fluorofori verdi o rossi.
Quando si tratta di imaging in fluorescenza o imaging multicolore, è meglio utilizzare fluorofori fototavola e molto luminosi, ad alto segnale-rumore con picchi di emissione distinti. Ciò consente di ridurre il tempo di esposizione. Il sistema ImageXpress include cubi filtro passaggio banda stretta per eliminare le interferenze. Include anche fonti luminose ad alta potenza che possono essere attenuate e controllate. Il sistema ImageXpress Confocal HT.ai, ad esempio, include una sorgente luminosa laser a sette canali con otto canali di imaging per accogliere gli esperimenti di marcatura multicolore, come le applicazioni di pittura cellulare.
Gli elevati obiettivi di apertura numerica (NA), come gli obiettivi di immersione in acqua, consentono di generare immagini più luminose e ad alta risoluzione a tempi di esposizione inferiori. Quando si utilizzano obiettivi NA elevati, è preferibile utilizzare micropiastre di plastica sottili o piastre di coltura (cioè quelle che hanno lo spessore di un coprioggetto). Anche l'uso di micropiastre a fondo trasparente a parete nera è preferibile, in quanto generano meno autofluorescenza.
5. Se appropriato, utilizzare gli Algoritmi di deconvoluzione delle immagini quando si utilizzano sistemi di microscopia a campo largo
I sistemi di microscopia a campo largo, come il sistema ImageXpress Pico e il sistema di imaging ad alto contenuto microconfocale ImageXpress®, sono ottimali per l’esecuzione di sperimentazioni di imaging con cellule vive. Per aumentare la risoluzione o la sensibilità con questi sistemi, è possibile utilizzare gli Algoritmi di deconvoluzione delle immagini. L'esecuzione del software di deconvoluzione delle immagini riduce la luce fuori fuoco durante l'acquisizione, consentendo di ridurre i tempi di esposizione e di mantenere la qualità del test. Tuttavia, la deconvoluzione deve essere applicata con precisione e cautela in modo da non generare manufatti.
6. Utilizzare sistemi di imaging confocale che consentono l'uso di sorgenti luminose laser ad alta potenza e binning
I sistemi di microscopia confocale come il sistema ImageXpress Confocal HT.ai includono sorgenti luminose laser che sono meglio utilizzate per l’imaging di campioni 3D, campioni spessi o fluorofori dim (ad es., proteine marcate fluorescentmente). Gli strumenti confocali consentono di regolare e controllare la potenza di intensità luminosa del laser e del LED.
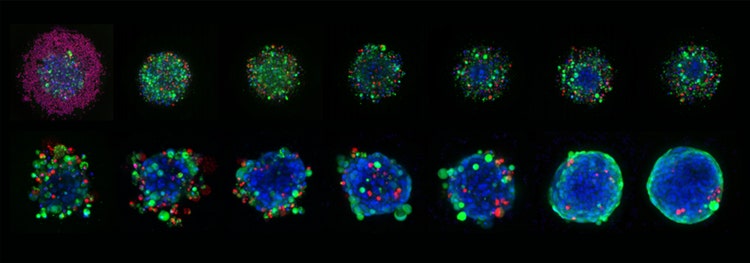
Immagini rappresentative 10X Plan Apo di sferoidi HCT116 cresciuti in piastre micro-cavità Corning Elplasia e trattati con concentrazioni variabili di staurosporina per sei giorni in totale. Gli sferoidi sono stati colorati con Hoechst 33342 (blu, nuclei), calceina AM (cellule verdi, vivi) ed etidium homodimer-III (cellule rosse, morte).
La binning è un altro strumento che può essere utilizzato quando si esegue l’imaging in campo largo o confocale, ma gli effetti della binning sono più evidenti quando si esegue l’imaging con strumenti confocali. Poiché la configurazione del disco rotante del sistema confocale limita la quantità di luce che colpisce il campione e blocca la luce fuori fuoco, in genere è necessario utilizzare tempi di esposizione più elevati o una luce a intensità più elevata. Binning allevia la necessità di fare questo combinando il segnale di carica o intensità elettrica da pixel adiacenti e generando una somma delle intensità di pixel in una determinata regione. Questa somma ti dà un'intensità più alta. Fondamentalmente, il binning aumenta il segnale al rumore nell'immagine, consentendo di utilizzare un tempo di esposizione inferiore e una minore intensità luminosa. Questo, tuttavia, riduce la risoluzione spaziale. Ancora una volta, è una questione di trovare l'equilibrio tra l'acquisizione di un'immagine di qualità e il mantenimento della salute del campione.
7. Utilizzare un potente software di analisi per ottenere dati riproducibili e significativi
Le applicazioni di diagnostica per immagini a celle vive richiedono la capacità di estrarre quantità rilevanti e grandi di dati quantitativi da immagini e set di dati grandi e talvolta complessi.
Le soluzioni di analisi ad alto contenuto (HCA) come il nostro software MetaXpress e CellReporterXpress® includono algoritmi di analisi robusti per segmentare accuratamente le immagini e generare dati riproducibili. Includono moduli di analisi preconfigurati per una serie di applicazioni di imaging di celle vive. È possibile eseguire un’analisi più personalizzata utilizzando l’editor del modulo cliente all’interno del software MetaXpress.
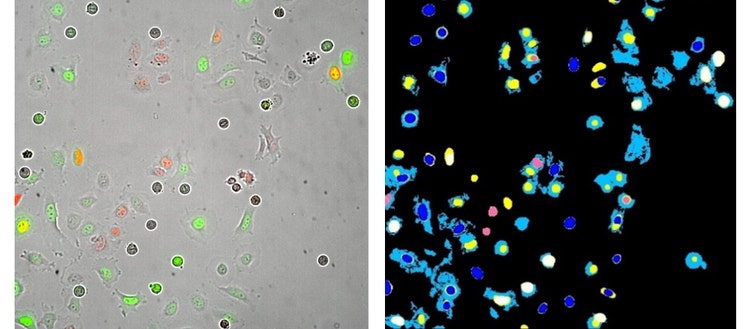
Sinistra : Immagine Apo del piano 20X delle cellule HeLa trasfette con i sensori del ciclo cellulare Fucci (GFP - gemina e RFP-Cdt-1). Questa immagine è stata acquisita 13 ore dopo il trattamento con l'inibitore del ciclo cellulare noccodazolo.
Destra : Maschere di segmentazione dell’analisi generate da un’analisi del modulo personalizzato MetaXpress.
Se stai cercando di ottenere informazioni più dettagliate sulle celle che vengono studiate, è possibile utilizzare gli algoritmi di macchina learning con funzionalità avanzate di analisi dei dati. Il nostro pacchetto software di analisi delle immagini IN Cartaý contiene flussi di lavoro di macchina guidati per migliorare la precisione dell’analisi e per ordinare e confrontare grandi quantità di dati di imaging eterogenei.
Poiché gli esperimenti di diagnostica per immagini con celle vive generano molti dati, è fondamentale avere un’adeguata capacità di archiviazione, nonché una potenza di elaborazione per l’analisi dei dati. Come accennato in precedenza, il binning può ridurre la dimensione dei dati dell'immagine e consentire una velocità di trasferimento dei dati più elevata in modo che le immagini possano essere analizzate più velocemente. Il sistema ImageXpress include anche il software di analisi delle immagini distribuite ad alto contenuto MetaXpress® Power Cores che utilizza l’elaborazione parallela per aumentare drammaticamente la velocità di analisi.
Per per saperne di più informazioni sulle varie applicazioni e tecniche utilizzate per l’imaging di cellule viventi, visitare la nostra pagina di imaging di cellule viventi.